神经退行性疾病,又称神经退化障碍(Neurodegenerative Disease),是一类以大脑和脊髓的细胞神经元逐渐退化死亡所直接导致的疾病,影响人类的运动感知与记忆认知相关功能。常见的神经退行性疾病包括阿尔兹海默症(AD)、帕金森症(PD)、亨廷顿病(HD)、渐冻症(ALS)。
大脑和脊髓由神经元组成,神经元有不同的功能,如控制运动,处理感觉信息,并作出决策。大脑和脊髓的细胞一般是不会再生的,所以过度的损害可能是毁灭性的,不可逆转的。目前仍然缺乏有效治疗手段来延长或阻断病人的发病时间及疾病进程。基因治疗对于遗传性疾病,特别是单基因突变导致的神经退行性疾病,是一种前景非常广阔的治疗策略。

2023年2月16日,暨南大学粤港澳中枢神经再生研究院李晓江教授,李世华教授,闫森研究员,联合中国科学院广州生物医药与健康研究院赖良学研究员,在Nature Biomedical Engineering 上发表了题为:Cas9-mediated replacement of expanded CAG repeats in a pig model of Huntington's disease的研究论文。该工作利用病毒载体表达CRISPR/Cas9基因编辑的技术敲除和修复亨廷顿猪模型的突变基因,首次在国际上证明基因治疗能有效的改善神经退行性疾病大动物模型的病理变化以及行为症状。
利用这个基因敲入猪模型,闫森等研究人员通过CRISPR/Cas9引起的同源臂重组将变异亨廷顿基因序列替换为正常人亨廷顿基因序列。同时还测试了脑部直接注射及周围静脉注射AAV病毒载体携带的CRISPR/Cas9对亨廷顿疾病模型猪的治疗作用, 两种方法都可以把变异亨廷顿基因序列替换为正常基因序列, 并能有效治疗大动物模型的病理变化以及运动症状。同时,该研究从多方面评估了这一治疗方法的安全性。亨廷顿疾病模型猪基因治疗的方式也为治疗其他神经退行性疾病提供了理论基础与新的思路。
近十年中,第三代载体(AAV9)被确定在脑和 脊髓中分布广泛,同时靶向神经元和星形细胞。与其他自然血清型不同,AAV9 在静脉注射后很容易穿过血脑屏障,具有 微创治疗的前景。因此,AAV9 已成为 AAV 介导的中枢神经系统基因治疗的金标准。
实验部分
文章作者使用原位定量分析作为主要手段,采用WB和ELISA作为校验。在脑部立体注射后4个月,免疫荧光染色显示GFP和Cas9 - HA信号在注射脑区分布丰富。在实验设计中,通过AAV携带绿色荧光蛋白和AAV携带Cas9在注射后目标脑区的表达量,证明其量化关系具有一致性,由此确立了实验基础的可行性。
在本文中,研究者以AAV9为载体,通过原位多色荧光的量化分析,建立了一种关于mHTT的潜在治疗及评估手段。从研究的方法学验证,到关键数据的量化分析结果,以及通过静脉注射并验证其透过血脑屏障的效果验证,皆使用了TissueFAXS Cytometry全景组织细胞定量分析技术。
在此基础上,TissueFAXS Cytometry技术还可以提供单细胞水平病毒表达的定量分析,以及多标记目标细胞或蛋白在脑区中的分布情况的定位研究,对于在脑神经科学领域的研究者们来说,相信这些数据可以提供更好更有利的观点佐证。
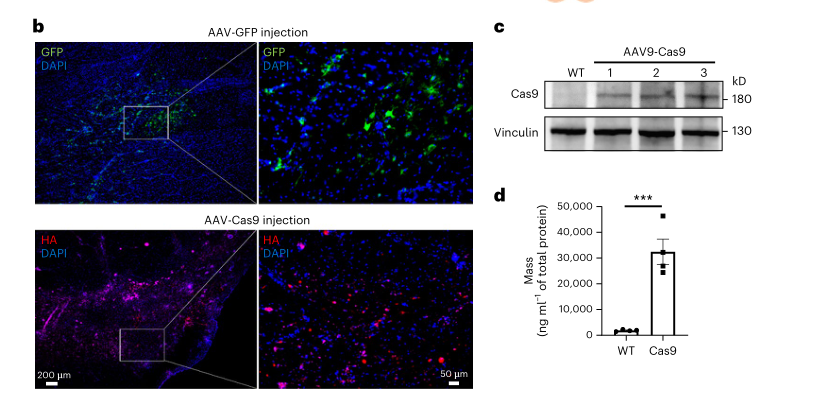
Fig 1 猪大脑组织中Cas9和GFP蛋白的表达量分析
B:注射AAV-GFP后的猪大脑纹状体GFP和Cas9-HA的免疫荧光样本蛋白表达。
在实验基础确立后,通过TissueFAXS Cytometry技术发现,AAV CRISPR/Cas9的注射导致gRNA在注射的脑区和神经元细胞中广泛的表达。
通过对比发现,不但注射AAV9-Cas9结合AAV9 HTT-gRNA-RFP-20Q(下行)与AAV-Cas9结合AAV9-gRNA-RFP-20Q相比,mHTT的出现减少,除了替换CAG重复外,CRISPR/Cas9介导的indel突变也可以改变阅读框,终止mHTT蛋白的表达,导致mHTT的表达减少。
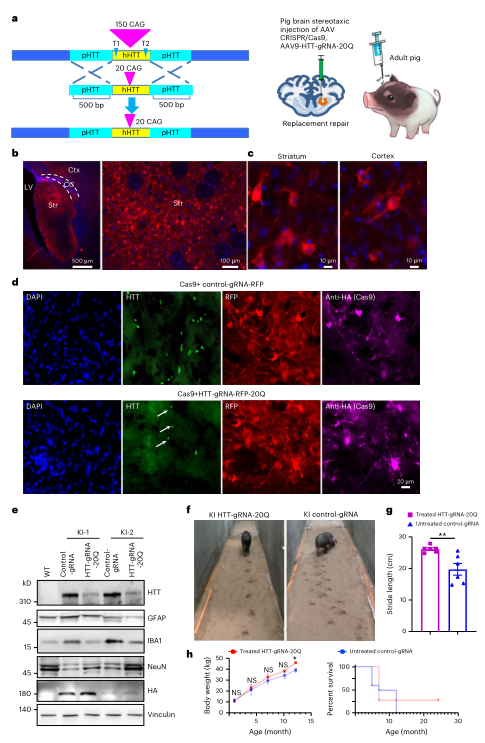
Fig 2 注射AAV9HTT-gRNA-RFP-20Q/Cas9的HD KI猪脑分析
B: 纹状体表达(右)中HTT-gRNA-RFP-20Q的RFP免疫荧光染色,以及包括部分皮质(左)。
C:AAV9gRNA-RFP在纹状体和皮质注射区域神经细胞中的表达放大图像
D:免疫荧光染色图像显示,注射AAV9-Cas9和AAV9 HTT-gRNA-RFP-20Q的7月龄HD KI猪大脑纹状体内mHTT减少(下排),与注射AAV9对照-gRNA-RFP的脑(顶排)相比。白色箭头表示mHTT的聚集体。Ctx,皮质;Str,纹状体;CC,胼胝体;LV,侧脑室。
通过TissueFAXS Cytometry技术证明,静脉注射可以使AAV穿透血脑屏障,在猪的全身有效分布。细胞内的AAV有效地分布在被注射猪的全身后,与注射猪脑的RFP免疫染色相比,RFP在大脑和周围组织中出现了广泛表达。
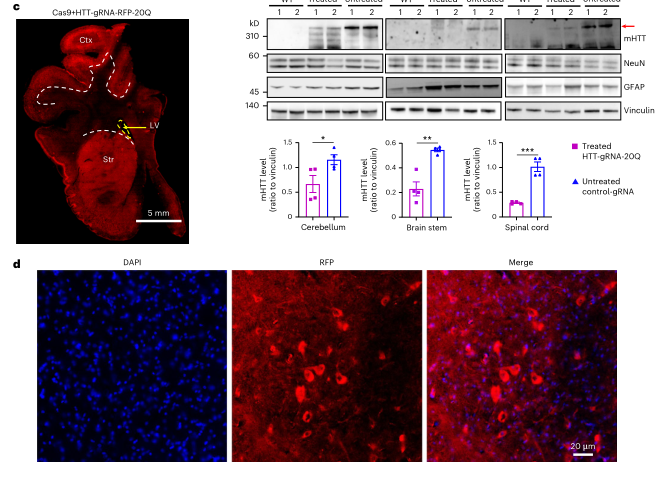
Fig 3 静脉注射AAV HTT-gRNA-RFP-20Q/Cas9分析
C:注射HD KI猪的RFP染色免疫荧光图像,显示RFP信号广泛分布。
D:注射AAV CRISPR/Cas9的猪大脑纹状体免疫荧光放大图像。
部分文字来源于“暨南大学新闻网”。