N-乙酰天门冬氨酸(NAA)是哺乳动物中枢神经系统CNS中最丰富的氨基酸衍生物之一,它在少突胶质细胞中被天门冬氨酰酶(ASPA)分解为L-天冬氨酸和乙酸。乙酸残基被认为有助于髓磷脂的合成。此外,NAA代谢的异常还与多种神经系统疾病有关,包括脑白质营养不良和脱髓鞘疾病,如多发性硬化。ASPA功能的遗传缺陷会导致卡纳万病,其特征是NAA水平升高,髓鞘和神经元丧失,CNS中出现大的空泡形成,并在儿童期早亡。尽管NAA在CNS中的直接作用尚不清楚,但在外周脂肪组织中,NAA衍生的乙酸已被发现能够修饰组蛋白,这是一种参与细胞分化的表观遗传调节机制。

2023年5月4日,美国麻省大学医学院红瑞基因治疗中心主任高光坪教授团队在Progress in Neurobiology上发表题为“Renewal of oligodendrocyte lineage reverses dysmyelination and CNS neurodegeneration through corrected N-acetylaspartate metabolism”的研究论文。
本文假设大脑中缺乏细胞分化导致了NAA代谢异常疾病(如Canavan)中的脱髓鞘和神经退行性变。研究表明,小鼠中ASPA功能的丧失会破坏髓鞘形成,并使神经元和少突胶质细胞标志物的转录表达向较低分化阶段转变。重新表达ASPA后,这些少突胶质细胞和神经元谱系标志物得到改善或恢复正常,表明ASPA对NAA的分解在神经元和少突胶质细胞的成熟过程中起着重要作用。此外,ASPA重新表达的效果在老年小鼠中受到抑制,可能是由于神经元而不是少突胶质细胞恢复能力有限。通过恢复ASPA酶的表达,可以改善NAA代谢紊乱,促进少突胶质细胞和神经元的恢复,从而纠正中枢神经系统的病理变化。
实验部分
本文使用TissueGnostics公司TissueFAXSiQ倒置高分辨全景快速扫描系统对全景脑组织切片进行免疫荧光图像采集。
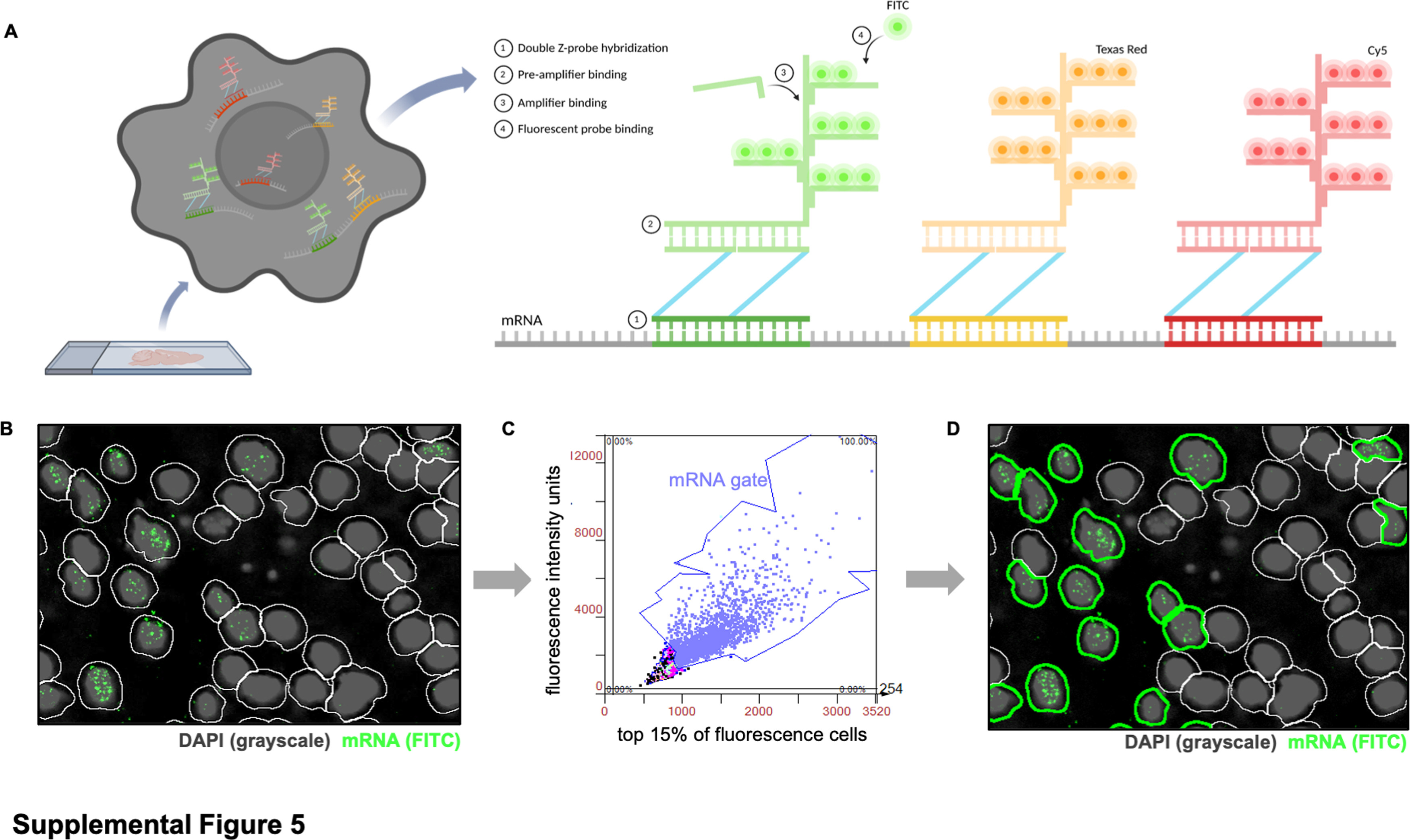
实验对10种以上RNA片段进行荧光标记,并且借助于TissueGnostics公司的Tissue Cytometry技术,更进一步获得了共聚焦级别的单细胞转录组水平可视的量化分析结果,以及对应细胞的形态学数据。考虑到相关数据分析是在全景成像以及Z轴全景深成像的基础上,得以确保数据的客观和真实性,最终在技术层面上实现了一次新的突破。
除此之外,Tissue Cytometry技术还可以支持组织原位30+以上免疫荧光染色的成像,同样可以在全景共聚焦级别的清晰度基础上,实现Z轴全景深成像的需求;在单细胞定量的维度之上还可以完成分子探针-蛋白标记-组织形态空间微环境分布的深度分析,无论从转录测序等技术的原位验证,还是作为一套拥有整套解决方案的标准化工具,皆可实现更多更深入的重要前沿研究课题的助力目标。
ASPA酶活性的恢复对受影响的脑区中Nestin表达的影响
在ASPA重表达后,小鼠脑中Nestin阳性细胞的数量增加了,尤其是在受损最严重的脑区,如丘脑、小脑、脑干和胼胝体。这可能表明ASPA重表达促进了神经干细胞或其他类型的干细胞的活化和增殖,为神经系统的修复提供了细胞源。

Fig 1 在ASPA重表达后,Nestin mRNA+细胞在中枢神经系统整体地增加,且呈现出区域特异性的分布。
(B)对皮质(CTX)、纹状体(STR)、胼胝体(CC)、海马体(HC)、丘脑(TH)、中脑(MB)、小脑(CB)和脑干(BS)区域的Nestin mRNA+细胞计数。
(C)TH、CB、BS、CC等脑区Nestin+ m RNA细胞计数。
(D) 注射4周后各脑区Nestin+ m RNA荧光阳性细胞的免疫荧光图像(绿色轮廓圈出)。
单细胞RNA的空间量化分析
将全脑矢状切片(每个实验组每个时间点3个)的组织样本图像导入StrataQuest软件。通过DAPI+细胞定位将后续多轮图像进行叠加,并使用ROI圈选感兴趣区域:皮层、胼胝体、海马、纹状体、丘脑、中脑、小脑和脑干。为了分析对荧光mRNA靶标呈阳性的单细胞,使用软件识别DAPI染色组织的细胞核。接下来,在每个核周围生成一个轮廓(白色),以标记每个细胞体的边界(图S5B)。然后,为了避免组织自发荧光造成的假阳性计数,为每个通道/mRNA靶标设置最大荧光强度(x轴)和总荧光强度单位(y轴)的检测参数,并将同一通道的相同设置应用于所有实验组。然后,根据mRNA点状物的最高荧光强度对细胞进行门限划分(图S5C)。最后,导出所有细胞(白色和绿色轮廓)、总mRNA+细胞(仅绿色轮廓)(图S5D)和总DAPI+细胞的计数。