非小细胞肺癌是肺癌中最常见的病理类型,大多数患者在确诊时已属晚期。对于驱动基因突变阴性的患者而言,目前的治疗仍以化疗为主,总体预后较差,改善治疗现状、获得长期生存是晚期患者最迫切的需求。随着肿瘤免疫治疗发展迅速,免疫检查点抑制剂(ICIs),为患者带来了生存获益,改变了NSCLC的治疗格局。
免疫检查点抑制剂(ICIS)联合化疗(化学免疫治疗)在非小细胞肺癌(NSCLC)新型辅助治疗中取得了良好的临床疗效,但临床反应机制尚不清楚。

7月13日,天津医科大学肿瘤附属医院任秀宝教授在Cell Death&Disease “Single-cell profiling of immune cells after neoadjuvant pembrolizumab and chemotherapy in IIIA non-small cell lung cancer (NSCLC)”的文章。对免疫细胞单细胞图谱的全面研究为基于抗PD-1的治疗机制提供了新的视角,并确定了潜在的预测因素和治疗靶点,以提高NSCLC新型辅助治疗的治愈率。
实验通过单细胞RNA-seq和TCR-seq从12例IIIA(N2)NSCLC患者(包括4例治疗初治和8例新型辅助化疗的非小细胞肺癌患者)的5个免疫相关区域。观察到B细胞和CD4+T细胞的协同增加与新型辅助化疗免疫治疗的阳性反应有关。
(免疫球蛋白是血液和组织液中的一类糖蛋白,由B淋巴细胞接受抗原刺激后增殖分化生成的浆细胞产生。IgG是血液和细胞外液中的主要抗体,主要在B细胞经过亲和成熟后的再次免疫应答中产生,是再次免疫应答中的主要抗体。)
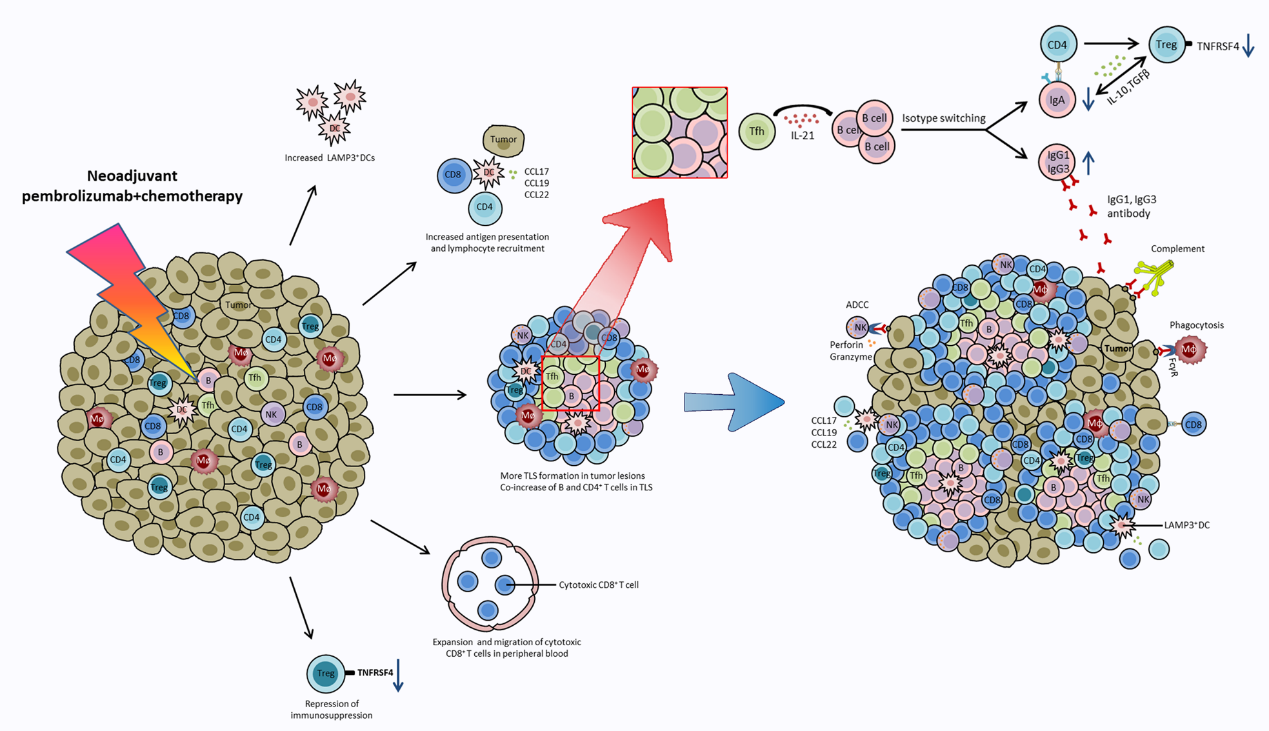
B细胞免疫球蛋白Ig G亚类IgG1和Ig G3在肿瘤病变的抗肿瘤免疫反应中起关键作用,而新型辅助化疗后浸润性T滤泡辅助性细胞(TFH)分泌IL-21的增加是这一过程的主要原因。
此外,我们发现了几个导致阳性临床结果的关键事件,包括激活的TNFRSF4+调节性T细胞(Tregs)减少,LAMP3+树突状细胞(DC)增加,以及肿瘤内CD4+T克隆和外周C3细胞毒性CD8+T克隆的扩张。对26名接受治疗的初治患者和30名新型辅助化疗免疫治疗的IIIA/IIIB非小细胞肺癌患者的验证证实了这些发现。
实验部分
对于三级淋巴结构TLS定量,使用TissueGnostics公司TissueFAXS Spectra全景多光谱组织扫描定量分析系统获取图像。获取到图像利用StrataQuest软件进行定量分析。这些结构是具有与淋巴组织相似的组织结构的淋巴细胞聚集体,具有生发中心(包括B细胞(CD20)、T细胞(CD4/CD8)和滤泡树突状细胞(CD21),在肿瘤区域。TLS密度被定义为在肿瘤区域内或与肿瘤边缘的肿瘤细胞直接接触的结构的总数量(每平方毫米的TLS数量)。

Fig 1 细胞及其分类对IgG介导的新型辅助疗法的效果相应
D: 肿瘤组织的多重荧光免疫图像。
E-F比较不同治疗组CD20+B细胞和免疫球蛋白(Ig)亚型比例。
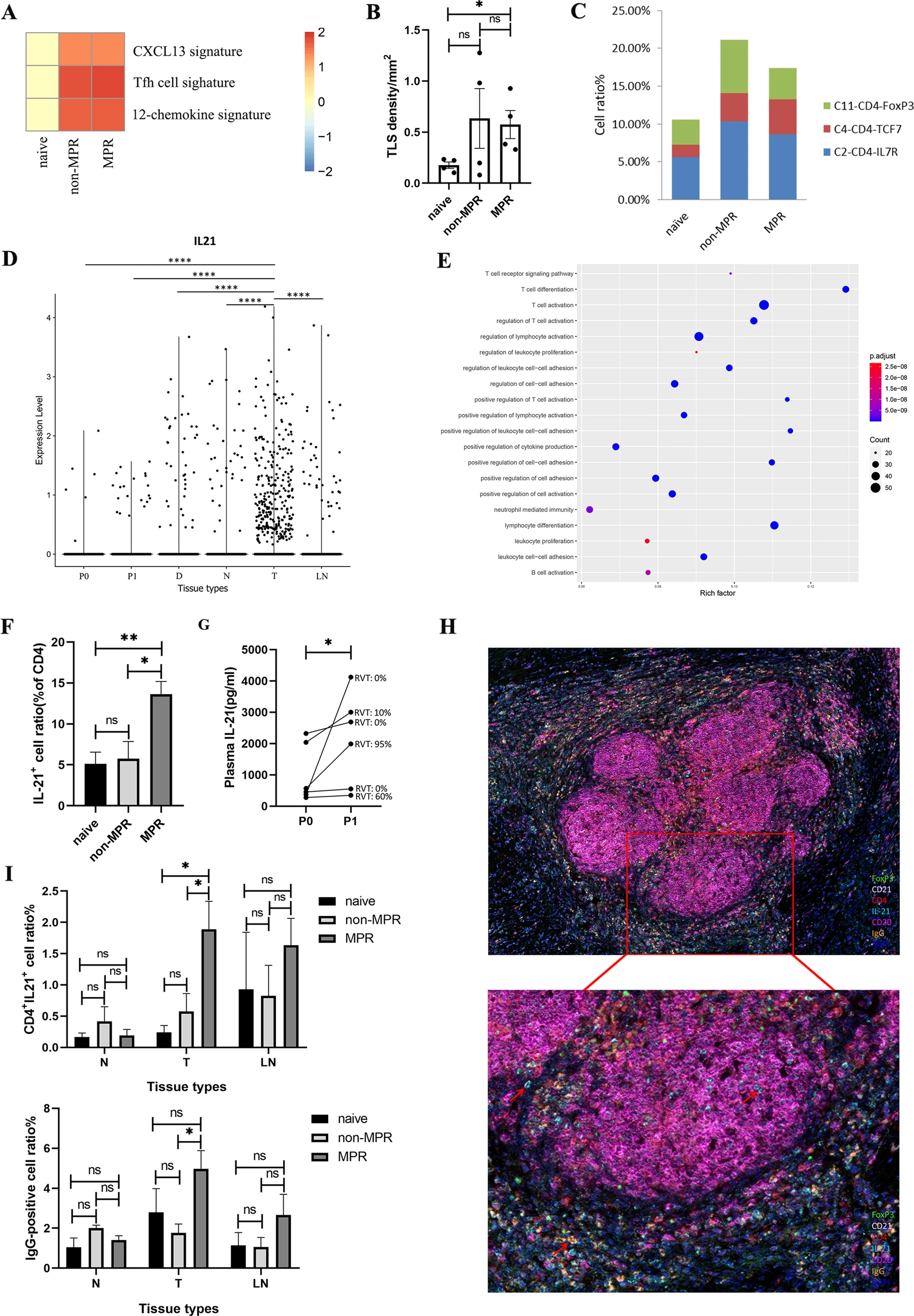
Fig 2 TFH分泌的IL-21在肿瘤病变中驱动B细胞向免疫球蛋白转化
H,I:多重免疫荧光染色图像显示MPR肿瘤组织中有大量的CD4+IL21+和Ig G阳性细胞。
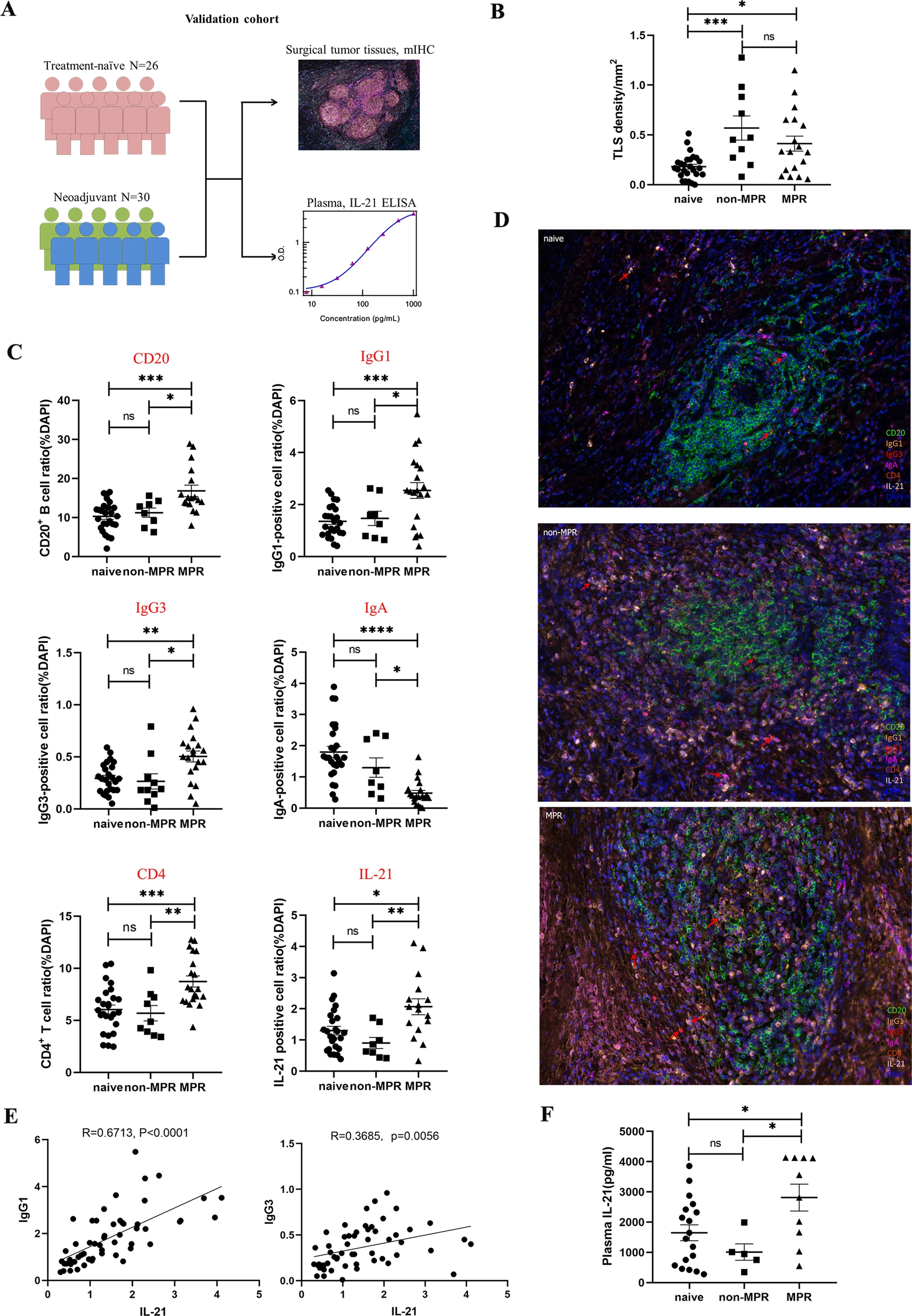
Fig 3 TLSs中B细胞亚类(IgG1和IgG3)和CD4+T阳性细胞的增加与对照组中临床疗效有关。
C、D:B细胞亚型、CD4、IL-21的多重免疫荧光图像显示CD20、IgG1、IgG3、CD4、IL-21在MPR肿瘤病变中显著升高,而IgA在MPR肿瘤病变中显著降低。
肿瘤三级淋巴结构(TLS)已经被认为是在抗肿瘤免疫过程中,对实体瘤生存具有一定影响的肿瘤相关组织结构。
三级淋巴结构在不同肿瘤组织中,其大小形态、分布数量均存在差异。TissueFAXS Cytometry技术可以通过AI训练的方法,根据淋巴细胞的密度,结合周边不同肿瘤间质的形态,不但实现对切片中所有三级淋巴结构的精准识别,还可以借助空间微环境的分析策略,以微米为尺度定义不同免疫细胞亚群在三级淋巴结构中心/周边的分布情况。通过这种技术,文章作者不但发现了NSCLC 肿瘤组织中新辅助化学免疫疗法可以刺激更多 TLS 的形成,更通过在TLS周边B细胞与CD4+T细胞的相互作用情况,推测TLS 的增加可能为肿瘤特异性 TB 细胞相互作用和协作提供理想的场所,还发现在肿瘤相关的 TLS 中,Tfh 细胞分泌的 IL-21 促进 B 细胞类别转换为 IgG1 和 IgG3,而不是 IgA 来介导抗肿瘤反应。