肿瘤相关巨噬细胞(Tumor-associated macrophages, TAMs)是浸润在肿瘤组织中的巨噬细胞,是肿瘤微环境中最多的免疫细胞,主要被认为具有促肿瘤作用。目前,靶向缺失TAMs已被用于肿瘤免疫治疗领域。同时,TAMs的表型和功能也是多样的,它可以通过吞噬肿瘤细胞和招募细胞毒性T细胞而成为抗肿瘤的部队,TAMs抗肿瘤和促肿瘤活性的主要控制机制则仍有待进一步探索。

近日,来自南京大学生命科学学院、医药生物技术国家重点实验室沈萍萍教授团队和深圳大学医学部朱卫国教授团队在巨噬细胞免疫功能重塑研究方面取得新进展,论文发表在Signal Transduction and Targeted Therapy(IF:18分)期刊上,文章揭示了糖异生代谢限速酶—丙酮酸羧化酶(PCB)发挥了非经典生物学功能,改变TAMs功能性极化表型而介导了肿瘤进展。
丙酮酸羧化酶(PCB)是糖异生过程中的重要组成部分,在控制糖异生中起主导作用。虽然肿瘤的发展程度与PCB在代谢中的典型功能之间的相关性正逐渐被揭示,但PCB在肿瘤微环境中是否以及如何调控免疫细胞,特别是TAMs的功能仍不清楚。文中通过实验证实肿瘤利用缺氧特性抑制TAMs中的PCB表达,这反过来又阻碍了TAMs的抗肿瘤作用,并增加了TAMs的免疫抑制特性。研究进一步表明在TAMs中修复PCB可以作为免疫治疗新策略。
实验部分


Figure 1
首先,作者通过免疫荧光技术分析了69块黑色素瘤和14块正常组织(TMA样本)PCB的表达情况,利用TissueGnostic公司TissueFAXS扫描系统对TMA样本进行图像采集,并使用TissueGnostic公司专业级组织原位定量分析系统StrataQuest对PCB的表达准确定量,结果显示在黑色素瘤患者中TAMs中的PCB表达量显著下降。
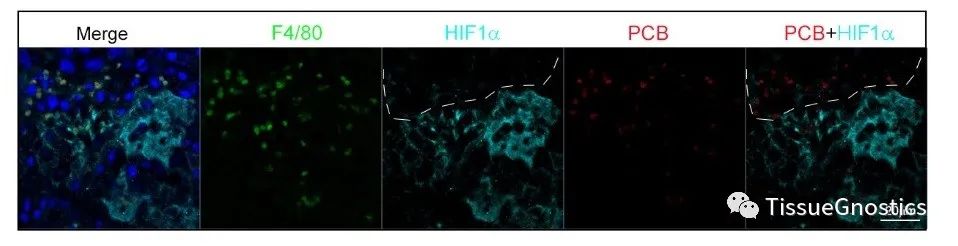
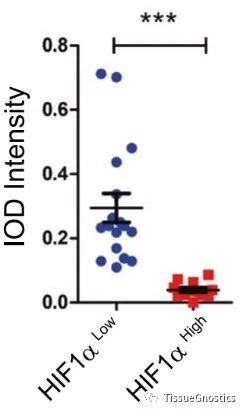
Figure 2
随后,考虑到缺氧是实体肿瘤的一个关键特征,同样,通过通过免疫荧光技术,使用TissueFAXS扫描系统对小鼠肿瘤切片进行扫描成像,StrataQuest定量分析发现位于HIF-α高表达区域的TAMs的PCB丰度低于位于HIF-α低表达区域的TAMs。
为了进一步确定PCB是否能够抑制肿瘤的生长行使抗肿瘤作用,作者通过氧气递送纳米颗粒FDC@HSA或者过表达PCB等手段证实巨噬细胞中PCB的上调能够通过介导CD8+ T 细胞和巨噬细胞,促进抗肿瘤效果。而在干扰PCB表达后,巨噬细胞中PD-L1的表达增加,更重要的是作者发现在人类黑色素瘤样本中,TAMs中PCB和PD-L1呈负相关模式,而这一数据的获得同样也是来自于使用StrataQuest对69例黑色素样本TAMs中PCB和PD-L1的丰度进行了量化。因此,表明PCB通过下调PD-L1降低了TAMs的免疫抑制能力。

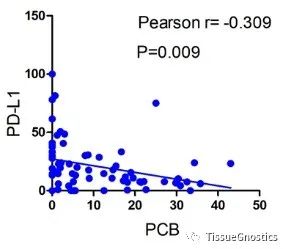
Figure 3
机制方面,文章表明PCB能够促进肌球蛋白MYH6与F-actin的结合而重塑巨噬细胞骨架,驱动TAMs对肿瘤细胞的吞噬。通过构建递氧/激活PCB的双功能纳米颗粒FDC-GTA@HSA,同时改善乏氧并激活PCB,抑制细胞IRF1-PD-L1轴,增强了微环境中CD8+ T细胞的浸润,逆转微环境免疫抑制状态。此研究结果不仅发现PCB 的非经典生物学功能与调控新机制,而且构建了“靶向干预TAMs极化”的专利技术,可用于进一步免疫治疗新策略构建。
