自从新冠大流行爆发以来,二次感染风险就一直是令人关注的问题。因为这关系到受到新冠病毒感染的人群产生的免疫力能否预防再次感染,以及免疫力能够持续多久。
我国香港在2020年8月份报告了全球首例再感染病例,人类针对新冠病毒不能建立长期有效的防止再次感染的免疫力,再感染是可能发生的。为什么新冠病毒的自然感染,不能使患者长期保有免疫力呢?
美国哈佛大学和布莱根妇女医院等机构的研究人员在2020年发表相关文章在CELL上。
研究表明在COVID-19疾病早期发现了缺陷的Bcl-6+TFH细胞生成和体液免疫诱导失调,从而为冠状病毒感染中抗体应答的有限持久性提供了机制解释。
持久的B细胞记忆和最高亲和力的病原体特异性抗体源自继发性淋巴器官的生发中心。
生殖器中心的解剖结构有助于选择寿命长的高亲和力B细胞。
研究人员利用对免疫细胞多种类型的准确识别、定量和定位,对患者的淋巴器官进行结构研究以及细胞间相互作用关系的分析。
文中利用Tissue Cytometry组织流式定量分析技术,结合多光谱成像和多色免疫荧光定量分析,对特定细胞表型进行识别与定量分析。
结果显示,COVID-19早期体液免疫诱导失调,包括在感染的最早阶段显著缺乏生发中心,生成Bcl6 + TFH缺陷细胞和异常的淋巴样TNF-α。
研究者最初推测,COVID-19患者中AID+ B细胞的存在,说明激活的辅助T细胞仍然与抗原特异性B细胞保持着频繁的接触,即使没有生发中心,T细胞-B细胞结合物(T-B conjugates)可能存在于滤泡内及滤泡外。
那么如何在组织中成千上万个细胞中准确找到这种细胞间的“接触”现象呢?
研究者利用TissueFAXS系统(TissueGnostics公司)对组织进行全景扫描,并通过StrataQuest软件对两种(T-B)细胞的细胞质重叠区域进行寻找和识别,根据一定的标准(邻近细胞marker间至少发生3个像素的重叠)。
以此来评估细胞-细胞相互作用,量化了细胞间质膜的接触和邻近程度,最终在COVID-19淋巴结和脾脏中鉴定出大量的T细胞-B细胞结合物,见Fig.1。
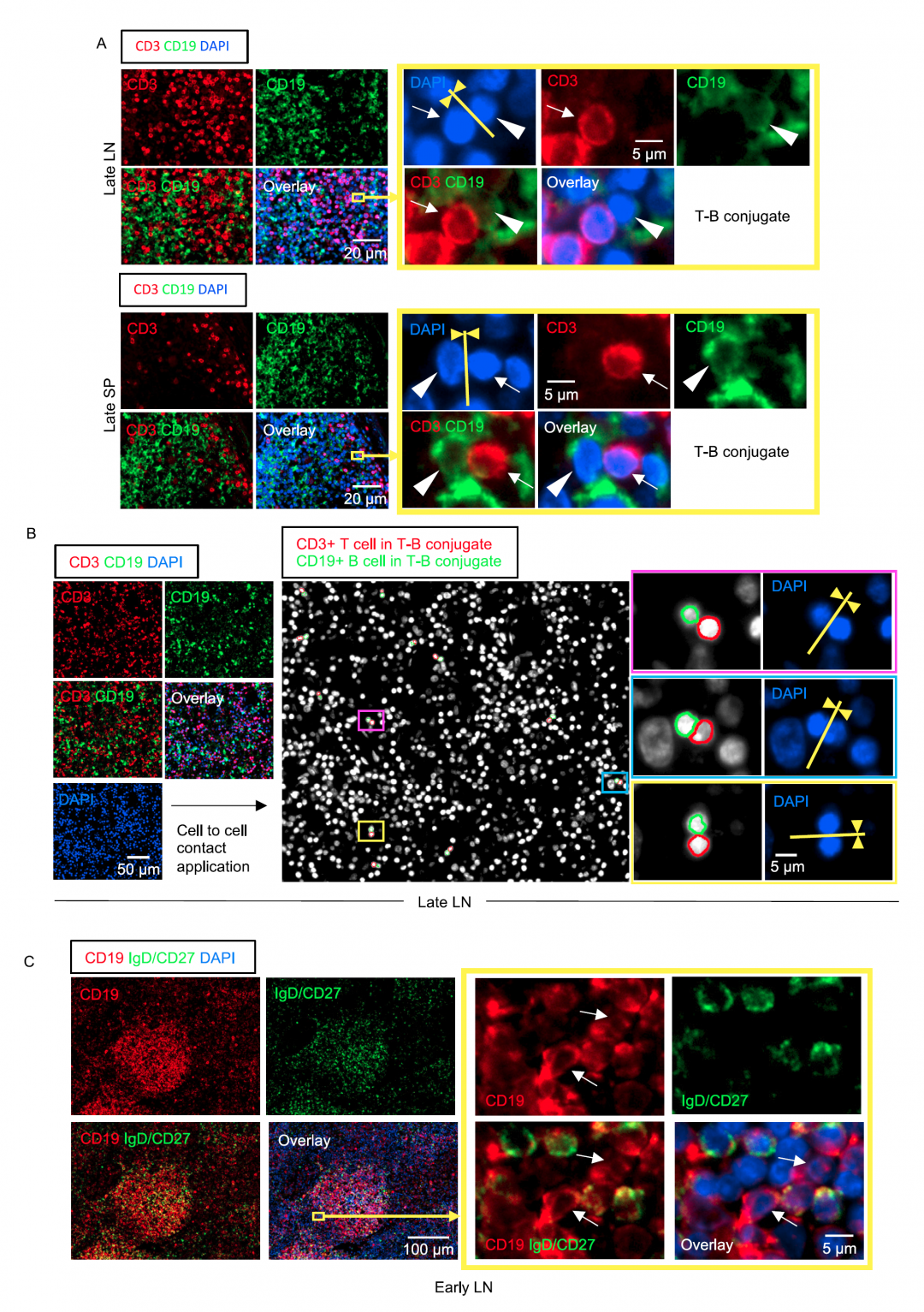
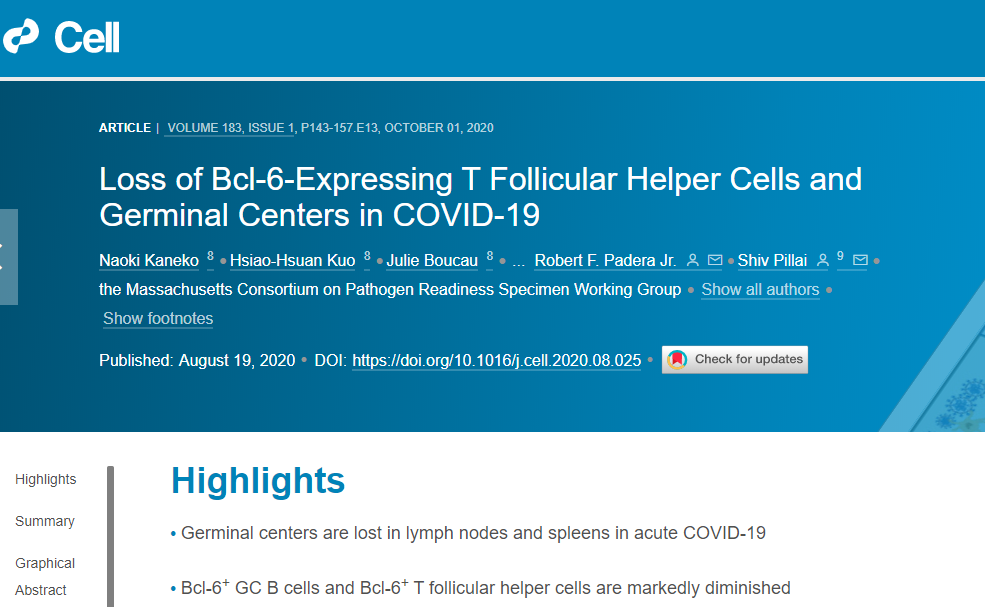
Fig.1 COVID-19患者淋巴结中滤泡和滤泡外T-B结合物与IgD-CD27-B细胞。
(A) 晚期COVID-19患者的淋巴结和脾组织免疫荧光染色图像:CD3(红色)、CD19(绿色)和DAPI(蓝色)。箭头分别表示CD3+T细胞和CD19+B细胞。黄色方框所示,T细胞和B细胞形成紧密广泛的细胞间质膜接触。
(B) 晚期COVID-19患者淋巴结组织免疫荧光染色图像(左图)和T-B结合物图像(中图和右图),红色和绿色圈出的细胞核分别代表CD3+T细胞和CD19+B细胞T-B结合物。
(C) 早期COVID-19患者淋巴结组织免疫荧光图像:CD19(红色)、IgD和CD27(绿色)及DAPI(蓝色)。大量IgD-/CD27-双阴性B细胞(红色染色,无绿色重叠)存在滤泡内和滤泡外。白色箭头显示IgD-/CD27-双阴性B细胞。
理论上,组织中表型为CD4+/Bcl-6+的T细胞包括TFH细胞和T滤泡调节细胞,但实际情况还需要进行鉴定,如果可以在组织同时呈现多种marker将十分有意义。
为了更好的对复杂的组织微环境中免疫细胞表型作出判断,研究者利用TissueFAXS Spectra多光谱成像系统(TissueGnostics 公司)对7色标记(DAPI,CD4,CD19,CXCR5,Bcl6,FOXP3,lgG)组织样本进行了成像和定量分析。
结果显示,尽管存在FOXP3+ Treg细胞,在COVID-19次级淋巴器官中Bcl-6和FOXP3表达没有重叠,表明在COVID-19患者中几乎没有T滤泡调节细胞存在,准确的完成了表型鉴定的目标。(Fig.2)
Fig.2 COVID-19淋巴结中T细胞增多,但未分化为TFR细胞。
(A) 晚期COVID-19患者淋巴结组织多光谱7色免疫荧光图像:CD4(红色)、CD19(绿色)、CXCR5(紫色)、Bcl6(白色)、FoxP3(黄色)、IgG(浅蓝色)和DAPI(蓝色)。滤泡内未见FoxP3+/Bcl6+细胞(白色染色,无黄色重叠)。
(B)COVID-19患者淋巴结的滤泡内和滤泡外IgG+浆母细胞。晚期COVID-19患者(左)和对照组(右)淋巴结中Bcl6(白色)和IgG(浅蓝色)染色的多色免疫荧光图像。
传统免疫荧光染色受限于通道数量,无法多方面对组织原位细胞的情况进行标记。
Tissue Cytometry技术对免疫细胞的多表型准确定量分析方面,在对组织样本多色标记的基础上,对每一个细胞进行识别,并分别对其每一个荧光染色通道进行亚细胞结构的形态学分析。
准确的判断任意蛋白共表达的细胞阳性率的情况,更可以在组织原位判断其相对的位置分布关系。
这种针对细胞功能的深度挖掘分析,为组织原位的免疫研究提供了更广阔更深入的技术手段,已经成为了当前研究者们的常用研究方法之一。