糖尿病是由于胰岛素分泌异常和/或功能受损引起的以高血糖为特征的代谢性疾病,长期代谢紊乱可引起多种严重并发症,是导致患者死亡的重要原因。β细胞质量和胰岛素分泌不足是2型糖尿病(T2D)发展的关键因素。
Tipe1作为肿瘤坏死因子α诱导蛋白,在多种生物过程中发挥重要作用。传统认为其在肿瘤相关巨噬细胞(TAMs)中高度表达,支持肿瘤生长转移,并与患者的生存率降低有关;除此之外作为脂质转运蛋白也能参与脂质代谢和细胞膜稳定性过程,以及在炎症调节中发挥重要作用。但在糖尿病代谢相关研究领域发表的科研成果较少,缺乏对比数据使其文章数据的发表对实验结果可靠性与可信性要求更高。

山东大学基础医学院马春红教授团队在Advanced Science发表题为“Beta-cell Tipe1 orchestrates insulin secretion and cell proliferation by promoting Gαs/cAMP signaling via USP5”的文章。研究结果表明,Tipe1通过Gαs/cAMP途径调节β细胞功能,提示Tipe1可能成为T2D干预的新靶点。

Tipe1被确定为T2D的关键调节因子,有助于维持β细胞的稳态。结果显示,β细胞特异性敲除Tipe1(称为Ins2-Tipe1BKO)加重了db/db小鼠或高脂饮食诱导糖尿病小鼠的糖尿病表型。值得注意的是,Tipe1通过依赖Gαs(G刺激蛋白的α亚基)的过程改善了β细胞质量和功能。在机制上,Tipe1通过招募去泛素化酶USP5抑制了Gαs的K48连接泛素化降解。因此,Gαs或cAMP激动剂几乎完全恢复了Ins2-Tipe1BKO小鼠中观察到的β细胞功能障碍。
实验部分
本文使用TissueGnostics公司TissueFAXS Spectra全景多光谱组织扫描定量分析系统对人胰腺癌样本进行多色荧光图像采集。通过Tissue Cytometry技术获得了精准的单细胞定量结果、空间定量数据及蛋白表达水平的量化。
多重免疫荧光标记技术(mIHC)的意义是通过一张组织切片样本进行成像分析,不仅在于可以从原位真正“看”到某个细化分型的关键细胞,更可以明确其分布的真实规律。在本文中,作者使用了Tissue Cytometry技术不但获得了多色切片中胰岛的准确轮廓,通过细胞核识别算法与细胞质形态学识别,在亚细胞水平上实现了单细胞蛋白表达的原位精准定量分析,更通过正反向回溯技术对关键蛋白Tip1表达情况及位置分布的重要性进行了双重确认,保证了数据的准确性及可靠性。
在通过Tissue Cytometry技术建立标准分析流程的基础上,对比胰腺癌组织芯片上获得的大量数据,肯定了Tipe1通过促进 G𝜶s/cAMP 信号传导作用,调节了胰岛 β 细胞的质量和功能,以及在机制上Tipe1 通过招募去泛素化酶 USP5,抑制 G𝜶s 的 K48 连接泛素化降解,从而提高 G𝜶s 的稳定性。

Figure 1 在db/db小鼠中,β细胞中Tipe1敲低导致严重的糖尿病表型
(N-P) Ins2-Cre-db/db和Ins2-Tipe1BKO-db/db小鼠胰腺组织的H&E染色图像,测量胰岛面积/胰腺面积比,胰岛面积。
(Q,R)免疫组化染色图像检测胰腺切片中胰岛素的蛋白水平,评估β细胞质量。

Figure 2 人胰岛β细胞中Tipe1和Gαs表达与血糖水平呈负相关。
A:来自患有和不患有T2D的胰腺癌症患者的胰腺癌旁组织的多重免疫荧光染色图像(TIPE1,绿色;胰岛素,橙色;USP5,红色;Gαs,紫色)。
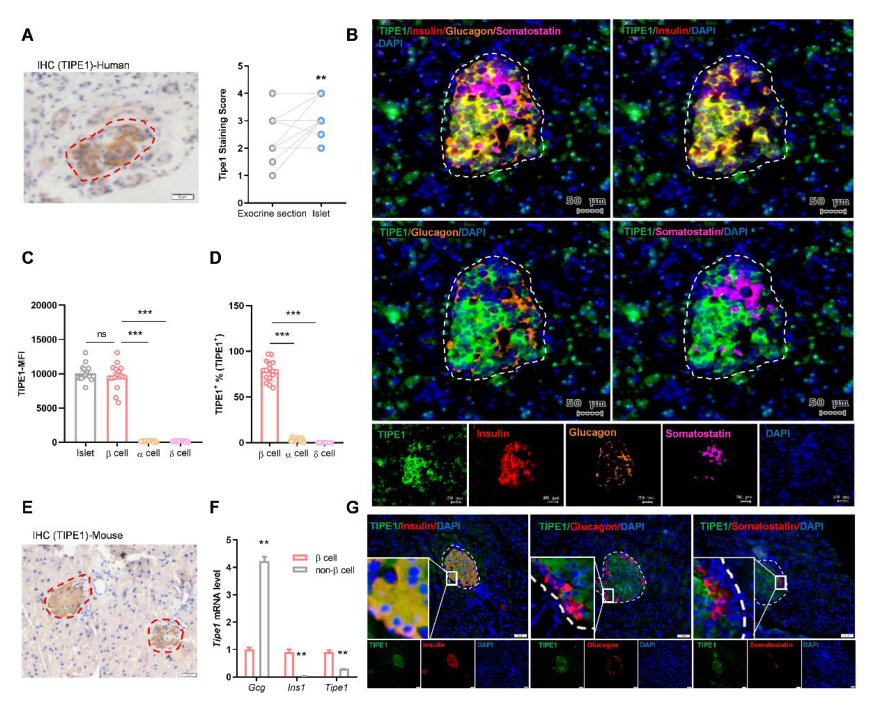
Figure S1 Tipe1在胰岛β细胞中高表达
(A)采用人胰腺癌组织芯片,用抗TIPE1抗体进行免疫组化染色,并对癌旁组织进行分析。
(B)胰腺癌患者癌旁组织多重免疫荧光染色图像(TIPE1,绿色;胰岛素,红色;胰高血糖素,橙色;生长抑素,粉红色)。
(C,D)胰腺癌患者癌旁组织中β,α和δ细胞中Tipe1表达的中位荧光强度和频率。
(E)取12周龄WT小鼠胰腺组织切片,进行抗TIPE1抗体免疫组织化学染色。细胞核苏木精染色(蓝色)。
(G)3月龄雄性WT小鼠胰岛β细胞(胰岛素,红色)、α细胞(高血糖素,红色)和δ细胞(生长抑素,红色)染色。细胞核用DAPI(蓝色)染色,TIPE1阳性细胞用绿色染色。
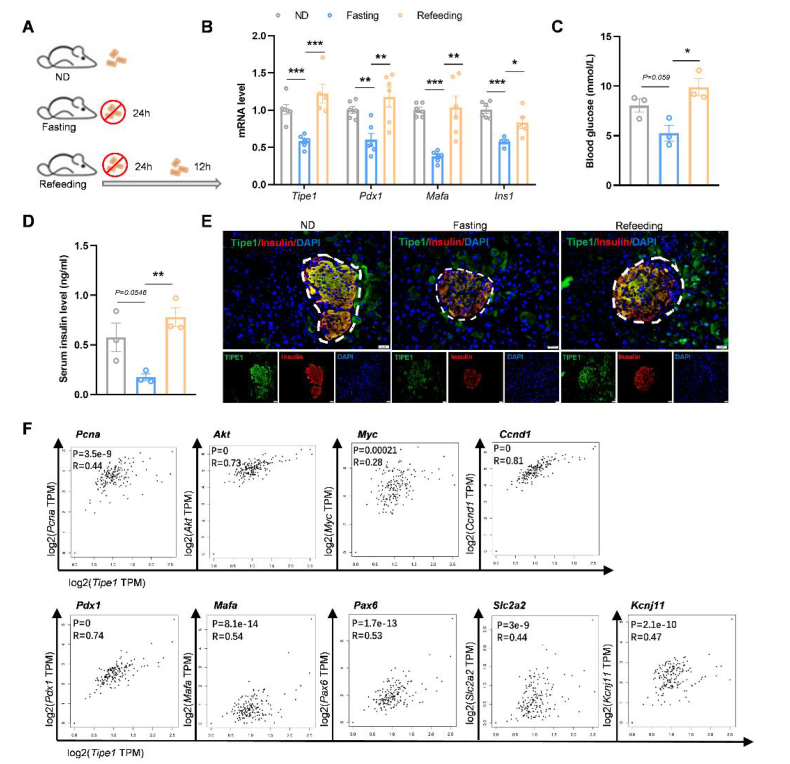
Figure S2 禁食状态下胰岛Tipe1的表达降低,重新摄食后表达恢复
(E) 用抗TIPE1和抗胰岛素抗体对禁食和再喂养小鼠的胰腺切片进行IF染色。