可变剪接的概念
可变剪接(Alternative Splicing)是指从一个前体mRNA(pre-mRNA)通过不同的剪接方式(选择不同的剪接位点组合)产生不同的mRNA剪接异构体的过程。这一机制在真核生物中广泛存在,是调节基因表达和产生蛋白质组多样性的重要方式。
基因序列中包含内含子和外显子,通过剪接体(spliceosome)的作用,内含子被移除,外显子被拼接在一起。然而,在可变剪接过程中,不同的外显子组合可以被选择性地保留或排除,从而产生多种不同的mRNA转录本和相应的蛋白质异构体。不同的剪接异构体可能具有不同的功能或活性,这种功能多样性使得可变剪接在调控复杂生理过程(如细胞凋亡、信号传导、免疫反应等)中具有重要意义。
可变剪接与蛋白质多样性
可变剪接是从相对简单的基因组提高蛋白质组多样性的重要机制。人类基因组中大约95%的多外显子基因存在可变剪接现象,一个基因通过可变剪接可以产生多种剪接异构体。例如,果蝇的Dscam基因通过可变剪接可以产生多达38,016种不同的蛋白质异构体[1]。这种多样性使得蛋白质组的复杂性远远超过基因组的复杂性,赋予生物体在不同环境和生理条件下更强的适应能力。
除此之外,可变剪接还通过调控mRNA的稳定性、翻译效率和定位来影响蛋白质的表达水平;不同的剪接异构体可能具有不同的修饰位点,从而改变蛋白质的功能、活性、定位和稳定性。
在基础研究中,转录组数据主要反映基因的转录水平,而蛋白质组数据则反映蛋白质的实际表达水平和功能状态。由于可变剪接的存在,蛋白质组数据和转录组数据之间可能存在显著差异。可变剪接可以导致同一个基因产生多种不同的mRNA和蛋白质异构体,这些异构体在不同的组织、细胞类型或生理条件下可能具有不同的表达模式和功能。因此,在研究中,转录组数据和蛋白质组数据可能会显示出不同的表达谱和功能特征。
蛋白质组数据研究的重要性与挑战
蛋白质组研究直接反映了细胞的功能状态和生理过程,是理解生命活动本质的核心。相比之下虽然转录组研究提供了有价值的信息,但蛋白质组研究更能揭示细胞功能的执行机制和调控网络。因此,蛋白质组研究在生命科学研究中具有不可替代的核心地位。
蛋白质组研究可以直接揭示细胞的功能状态、代谢活动和信号传导过程,而这些在转录组水平可能无法准确反映;翻译后修饰(如磷酸化、糖基化、泛素化等)对蛋白质功能至关重要。这些修饰只能通过蛋白质组学方法检测,是理解蛋白质活性调节和信号传导的关键。空间转录组技术可以精准分析不同细胞基因表达的差异,但mRNA水平并不总是与蛋白质表达水平相关,结合蛋白质组学直接测量蛋白质的实际表达水平,更准确地反映基因表达的最终结果。
蛋白质组学的复杂性为技术开发带来了巨大挑战。由于翻译后修饰产生了大量异构体,且这些异构体通常以复合物形式存在并发挥生物学功能,因此需要特殊技术来追踪多标记蛋白和进行超多蛋白表达的定量分析。蛋白质组学分析需要更高的灵敏度和更广的检测范围,以覆盖蛋白质表达水平的广泛动态范围。
Tissue Cytometry在蛋白质组研究中的应用优势
Tissue Cytometry技术作为一种先进的生物医学研究工具被广泛用于空间蛋白质组学研究,其多标记分析能力在单细胞水平上提供了前所未有的细胞分析精度,并通过多色免疫荧光定量分析则进一步增强了其在精准医疗领域的应用潜力。这项技术不仅能够检测多个抗原,还能保留细胞的空间位置信息,这对于研究细胞如何在组织中相互作用以及它们在微环境中的行为至关重要。
结合AI技术,Tissue Cytometry能够实现精准的形态学分割和空间定位,这在多组学整合分析中尤为重要。该技术在高水平学术期刊上发表的2700+研究成果,证明了其在科学研究中的重要价值和可靠性,在癌症治疗、免疫学研究等领域正在积极推动个体化医疗和靶向治疗的发展。这些优势共同塑造了Tissue Cytometry技术作为空间蛋白组学研究的强大工具的地位,有助于科学家们更深入地理解细胞在组织微环境中的复杂交互和功能状态。
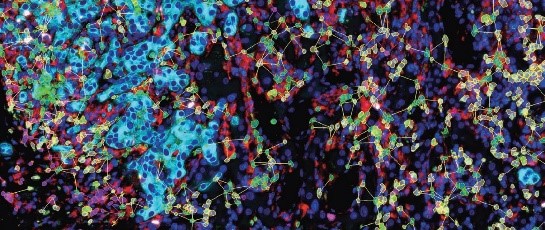
Tissue Cytometry技术拥有独特的动态可视化流式散点图分析方法,正反向回溯追踪校验目标组织结构、单细胞甚至单个核酸荧光分子的表达强度及位置,这种追踪甚至可以直至目镜,通过肉眼直接判断数据分析策略方法的合理性及准确性。大量应用TC技术发表的高水平研究文章证明研究者已经把TC技术作为衡量其他研究技术的可信程度,提取组织原位数据进行验证的可靠工具之一。
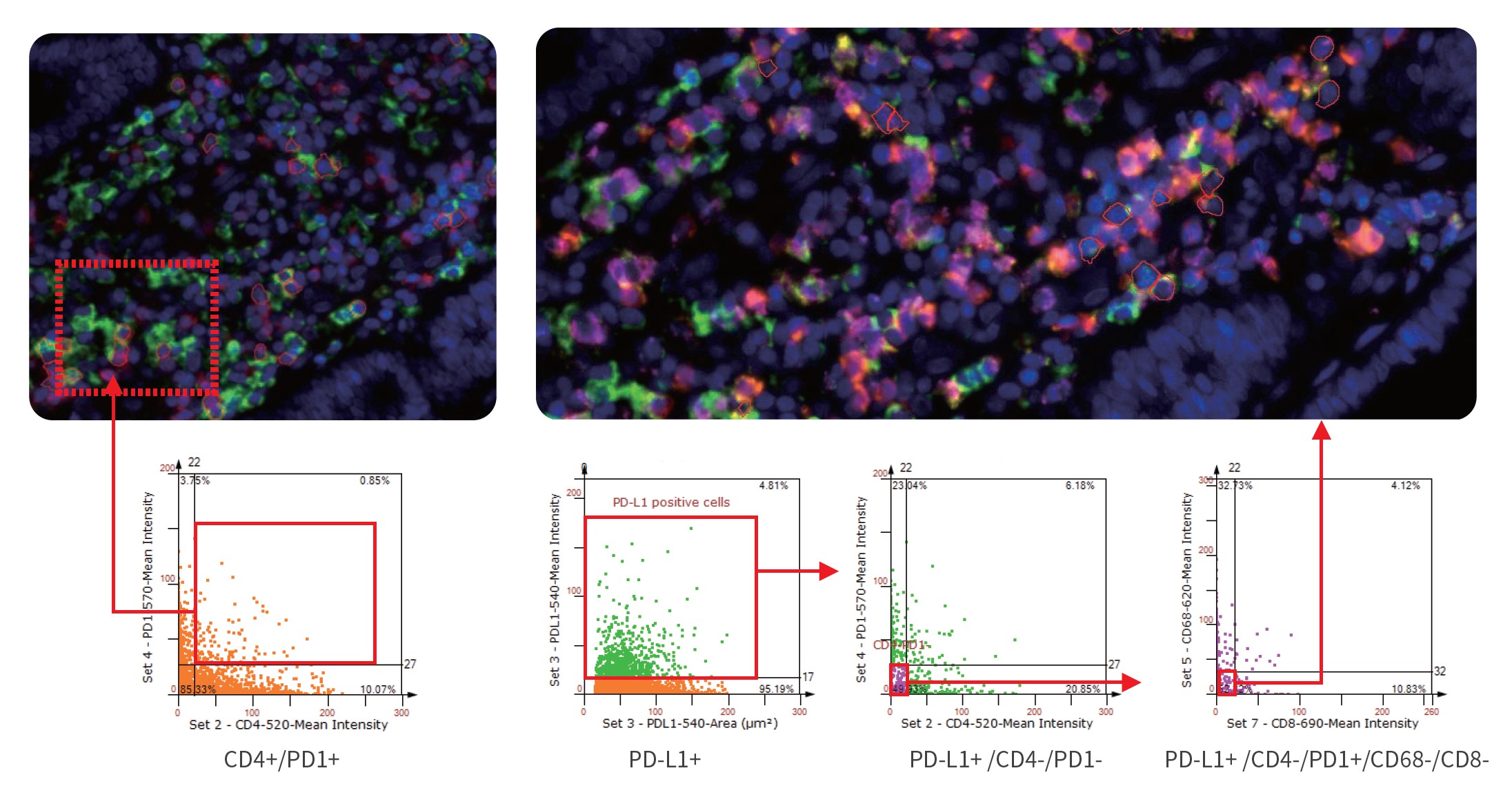
TC技术发表文章及案例
1. 癌症转移相关分子机制研究
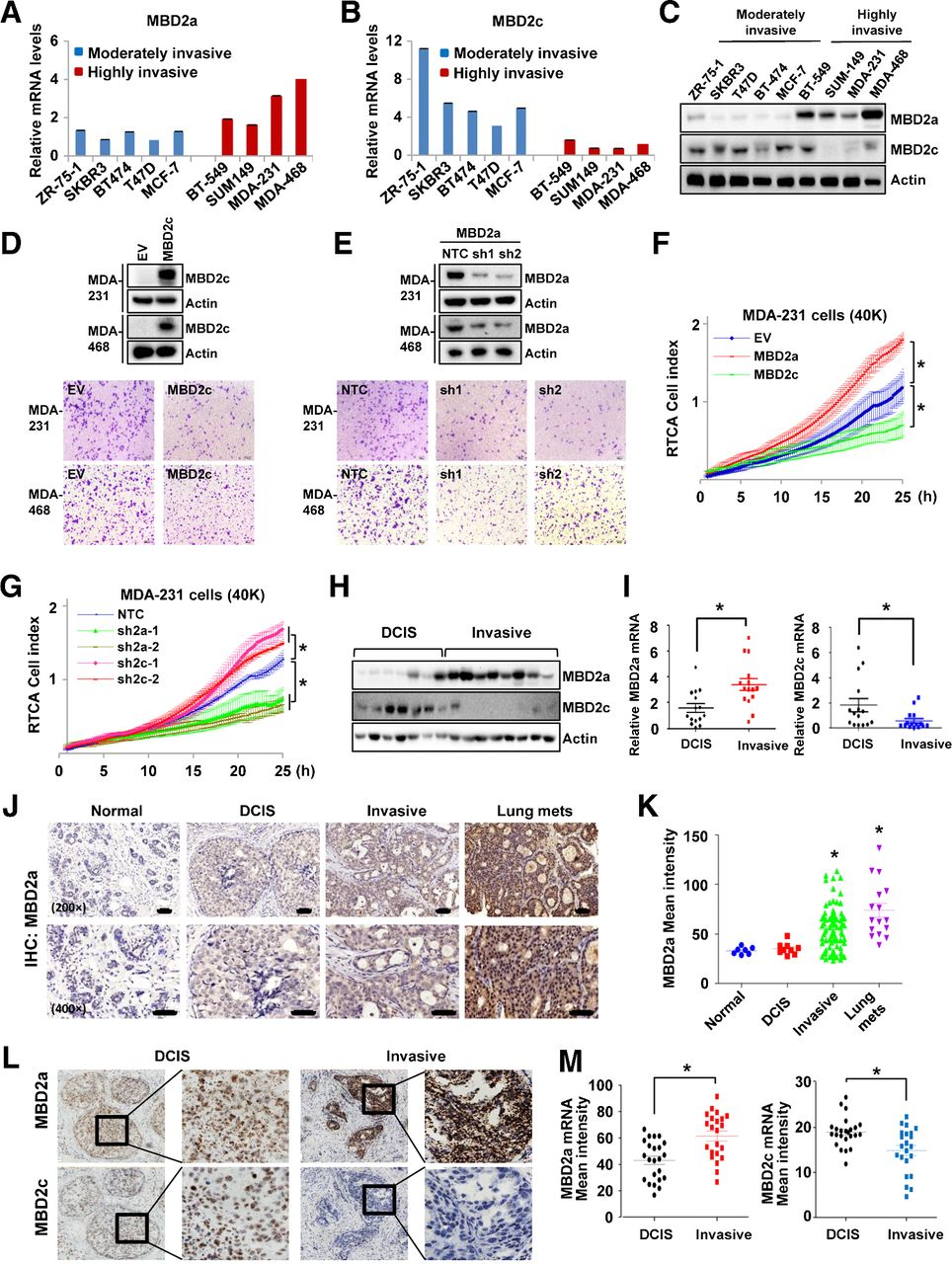
中国科技大学张华凤教授课团队与南方医科大学高平教授课题组联合发表文章《缺氧诱导的 MBD2 剪接抑制通过激活 FZD1 促进乳腺癌转移》[2],阐明了低氧条件下MBD2可变剪接的调控机制,以及不同MBD2异构体在乳腺癌转移中的相反作用,为理解乳腺癌转移机制提供了新的视角。

文章使用TissueGnostics公司的HistoQuest软件进行定量分析,研究MBD2a在正常乳腺组织、原位导管癌(DCIS)、侵袭性癌症和乳腺癌相关的肺转移中的表达情况。
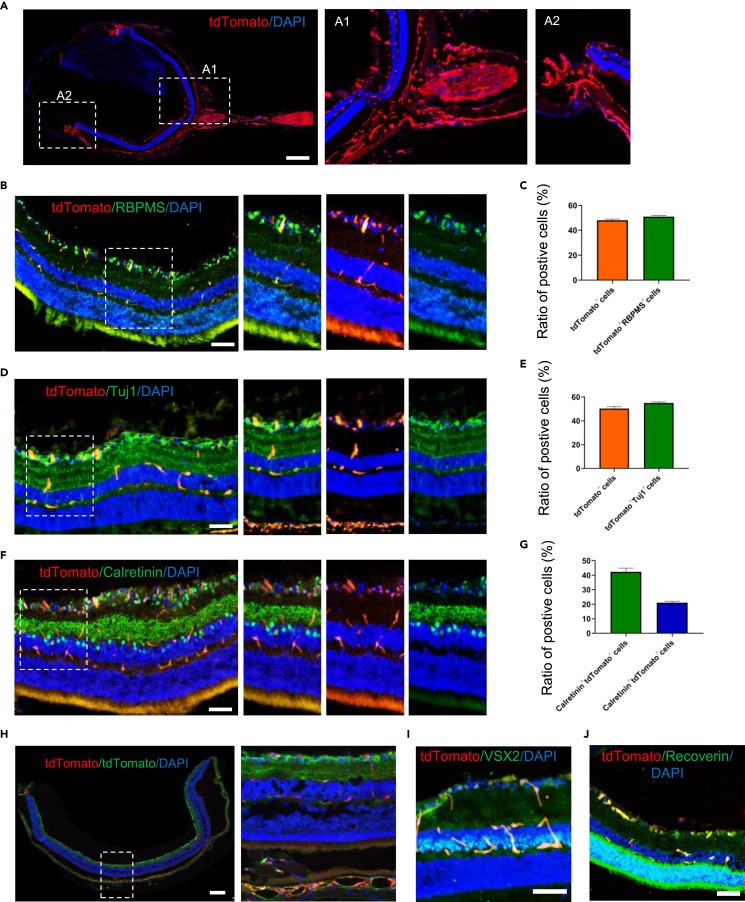
2. 构建具有特殊用途的动物模型

中山大学眼科中心郑颖丰教授团队在Cell子刊发表题为《研究视网膜和血管相关疾病的 RBPMSCreERT2-tdTomato 小鼠品系》[3] 的文章。作者开发了一种新的RBPMSCreERT2-tdTomato报告小鼠系,用于跨各种组织追踪RBPMS+细胞的谱系,特别是在视网膜神经节细胞(RGCs)和平滑肌细胞中。利用这种小鼠系模拟视网膜退行性疾病,并在体内无创地检查脉络膜新生血管形成。RBPMSCreERT2-tdTomato小鼠系可用于疾病建模、药物筛选以及分离特定靶细胞,为相关研究提供了宝贵工具。
本文讨论的视网膜成像和分析,采用了TissueGnostics公司的2D/3D多维全景组织细胞定量分析系统。该系统不仅利用共聚焦原理清晰成像厚视网膜,而且其多通道免疫荧光成像速度是传统共聚焦的5到10倍,显著提高了高清成像的通量。
3. 肺癌中不同亚型蛋白的功能研究

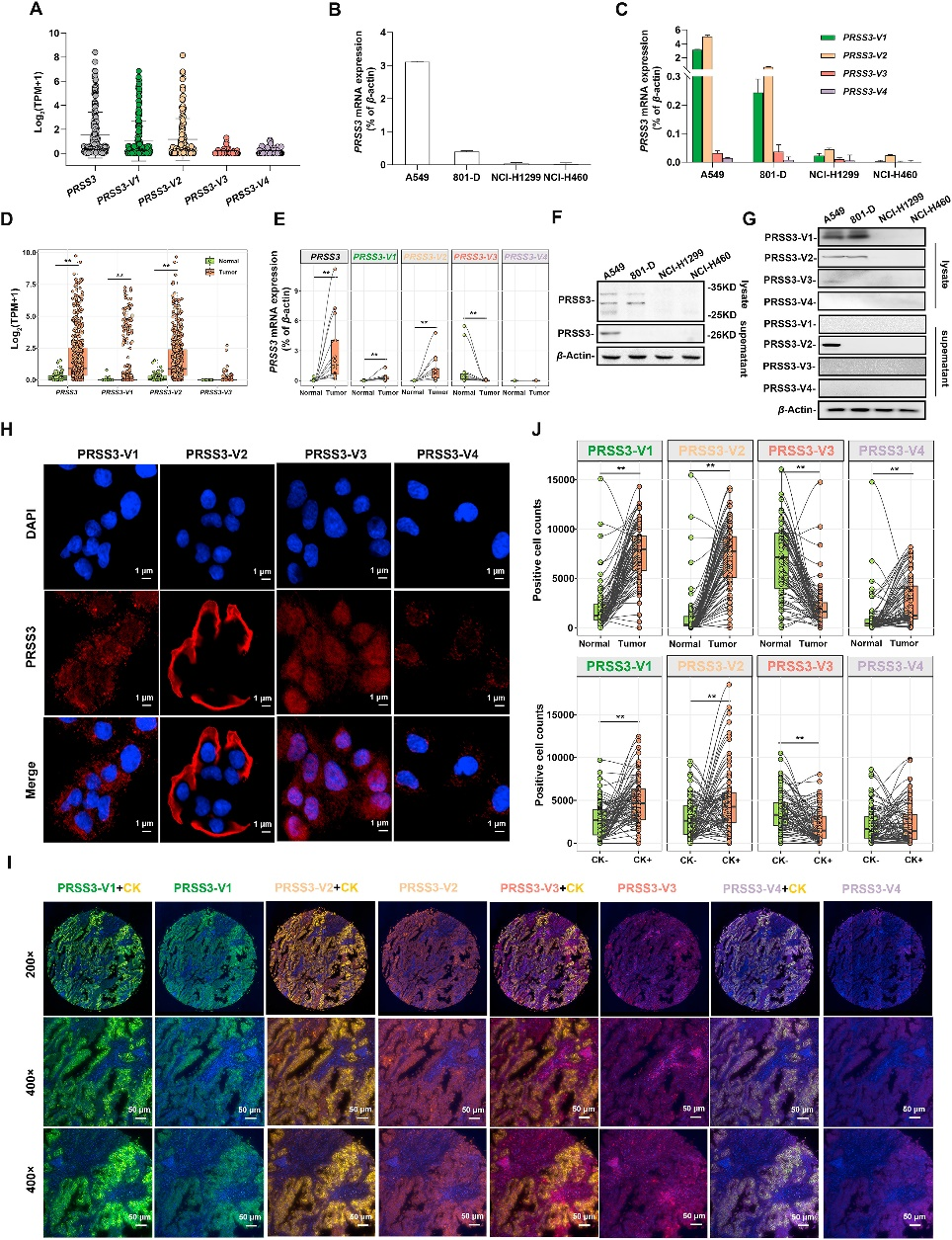
随着对参与表型可塑性的RNA异构体的困惑增加,异常的CpG甲基化介导的选择性剪接中断越来越被认为是肿瘤内异质性(ITH)的驱动因素。蛋白酶3(PRSS3)具有4种亚型,即PRSS3-V1到V4,是一种不可或缺的胰蛋白酶,对肺癌的发展有不同的影响。在肺癌中,作者发现PRSS3基因的转录本及其剪接变体在肺癌中表达不同,具有相反的功能和临床结果,即具有致癌性的PRSS3-V1和PRSS3-V2与具有抑癌性的PRSS3-V3。
2023年5月,首都医科大学附属北京胸科医院肿瘤研究中心黄家强教授团队在Acta Pharma Sin B上发表了题为 《UHRF1/DNMT1eMZF1 axis-modulated intragenic site-specific CpGI methylation confers divergent expression and opposing functions of PRSS3 isoforms in lung cancer》[4]的研究论文,探讨了UHRF1/DNMT1–MZF1轴通过调节基因内CpG岛甲基化(Intragenic CpG Methylation, iCpGIm)来调控PRSS3剪接变体的表达差异,从而导致非遗传功能的肿瘤内异质性。
[1]Schmucker, Dietmar, et al. "Drosophila Dscam is an axon guidance receptor exhibiting extraordinary molecular diversity." Cell 101.6 (2000): 671-684.
[2]Liu, Zhaoji, et al. "Hypoxia-induced suppression of alternative splicing of MBD2 promotes breast cancer metastasis via activation of FZD1." Cancer research 81.5 (2021): 1265-1278.
[3]Li, Guilan, et al. "The RBPMSCreERT2-tdTomato mouse line for studying retinal and vascular relevant diseases." Iscience 26.11 (2023).
[4]Lin, Shuye, et al. "UHRF1/DNMT1–MZF1 axis-modulated intragenic site-specific CpGI methylation confers divergent expression and opposing functions of PRSS3 isoforms in lung cancer." Acta Pharmaceutica Sinica B 13.5 (2023): 2086-2106.