核受体PPARγ (Peroxisome proliferator-activated receptor gamma)是细胞感应外界物质与能量信号的分子感受器,亦是控制细胞代谢流动,调控细胞命运的效应器。
近年来,南京大学沈萍萍教授团队在PPARγ 翻译后修饰相关蛋白质机器解析,关键代谢调控分子元件鉴定等方面,取得了系列的研究成果,并相继发表于Signal Transduct Target Ther、Nat Commun,Adv Sci等杂志。
近日,沈萍萍教授团队与温州医科大学李校堃院士团队合作,于该领域内又取得一项重要突破:首次在PPARγ 的DNA结合区(DNA binding domain, DBD)中鉴定了一种全新的翻译后修饰模式—T166磷酸化,并确证其为控制米色脂肪细胞分化发育的分子“开关”。

目前,该研究成果以“Blockage of PPARγ T166 phosphorylation enhances the inducibility of beige adipocytes and improves metabolic dysfunctions”为题,于2022年11月03日在Cell Death & Differentiation上在线发表。
实验部分
1. 在本研究中,为了能够系统地评估PPARγ T166磷酸化调控的脂肪组织米色化的效能,研究团队运用了TissueGnostic公司的TissueFAXS扫描系统对小鼠整块皮下脂肪组织的最大纵向横截面进行了全景定量分析与精确地数据采集,全面获取了脂肪细胞大小、脂滴尺寸、脂滴形态等信息。
2. 并通过TissueGnostic公司专业级组织原位定量分析系统StrataQuest对获取到的数据信息进行进一步的统计分析,发现PPARγ T166磷酸化可阻碍脂肪细胞内脂滴多室化,促进1000-1000μm2的大脂滴的形成,而干预PPARγ T166磷酸化可逆转此过程。
3. 此外,通过运用该系统,研究团队还对PPARγ T166磷酸化位点的点突变小鼠脂肪细胞内脂质含量进行了评估,并发现PPARγ T166磷酸化可介导脂肪细胞内的脂质堆积(图1)。
这些在脂肪组织中获得的精确且系统的分析数据明确了PPARγ T166磷酸化的生物学功能,亦为文中后续的机制研究奠定了基础。
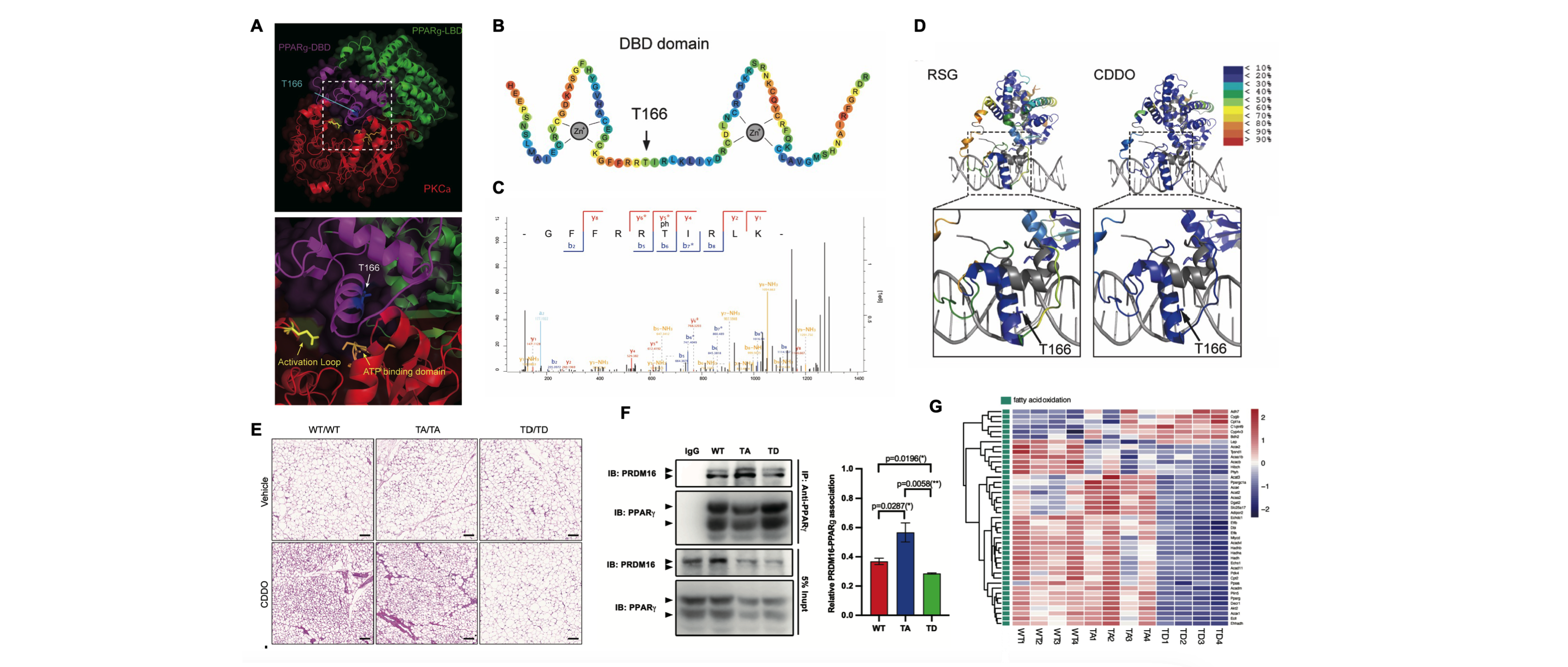
图1. TissueFAXS系统应用于脂肪组织米色化重塑的全景定量分析
进一步的机制研究发现T166 位点位于PPARγ的DBD两个锌指结构的中央,当该位点被蛋白激酶 PKCa催化并发生磷酸化修饰时,可改变 DBD 构象,并通过别构调节的方式,影响配体结合区(Ligand binding domain, LBD)与转录辅因子的结合,进而调控 PPARγ 的转录活性与转录偏好性,影响米色脂肪细胞的分化与机体糖脂代谢稳态。鉴于PPARγ T166磷酸化在脂肪细胞代谢重编程中的重要调控地位,本研究进一步针对PKCa-PPARγ 分子互作关联,设计了相应的基因/化学干预策略,并在动物模型中成功应用,高效诱导了米色脂肪细胞的生物发生,改善了胰岛素抵抗、高血脂等代谢紊乱状态。该研究不仅提出了PPARγ翻译后修饰调控脂肪细胞分化与代谢功能的新机制与新理论,拓宽了对PPARγ生物学功能的认知,更提供了促进米色脂肪细胞分化而治疗代谢性疾病的新方法。
在该研究论文的Materials and methods中对TissueFAXS扫描系统全景定量分析脂肪组织结构形态的过程及相关参数进行了系统的阐述,并在Acknowlegements中特别感谢了TissueGnostic公司的技术团队的对该项目研究的技术支持。
