肺癌是最常见的癌症类型,肺癌病例的85%为非小细胞肺癌(NSCLC)。非小细胞肺癌中一个极其重要的驱动突变基因是表皮生长因子受体(EGFR),大约三分之一的肺腺癌中都发现了其突变。EGFR突变可以赋予肿瘤细胞更强的CD8+T细胞的抑制功能,EGFR突变的肺腺癌亚型(EGFR MT)在TME中的B7-H4表达增强,CD8+ TILs功能降低,这与抗PD-1疗法的不良反应有关。最近,越来越多的临床研究将 B7-H4 作为肿瘤免疫治疗策略的靶点。
近日,苏州大学药学院章良课题组在Cancer Letters发表题为“The deubiquitinase USP2a promotes tumor immunosuppression by stabilizing immune checkpoint B7–H4 in lung adenocarcinoma harboring EGFR-activating mutants”的文章,研究了去泛素化酶 USP2a 在肺腺癌中的作用,特别是其如何通过稳定免疫检查点 B7-H4 来促进肿瘤免疫抑制,提供了一个潜在的肿瘤治疗靶点。

这项研究发现,B7–H4 是一个关键的免疫检查点,能够抑制 CD8+ T 细胞的活性。目前正在进行一项临床试验,研究 B7–H4 作为潜在免疫治疗剂的作用。然而,B7–H4 通过泛素-蛋白酶体途径(UPP)降解的调控机制仍然不清楚。在这项研究中,我们发现蛋白酶体抑制剂有效地增加了 B7–H4 的表达,而 EGFR 激活突变体通过 UPP 促进了 B7–H4 的表达。
通过进一步研究 USP2a 在体内肿瘤生长中的作用。发现在免疫健全的 C57BL/6 小鼠肿瘤模型中,USP2a 的缺失促进了 CD95+CD8+ 效应 T 细胞的浸润,并通过破坏 B7–H4 的稳定性阻碍了 Tim-3+CD8+ 和 LAG-3+CD8+ 耗竭 T 细胞的浸润。临床肺腺癌样本显示,B7–H4 的丰度与 USP2a 的表达显著相关,表明 EGFR/USP2a/B7–H4 轴对肿瘤免疫抑制的贡献。
实验部分
文章使用TissueGnostics公司TissueFAXS Spectra全景多光谱组织扫描定量分析系统获取图像。通过Tissue Cytometry技术获得了精准的单细胞定量结果、空间定量数据及蛋白表达水平的量化。
Panel 1:EGFR、Cyclin D1、PCNA、Ki67、DAPI
Panel 2:EGFR、CD8、PD-1、TIM-3、LAG-3、DAPI
Panel 3::EGFR、CD8、CD137、CD95、CD69、DAPI
Tissue Cytometry技术,也称为组织细胞定量分析技术,是一种先进的组织成像和分析方法,不仅能帮助临床医师更深入地理解肿瘤的生物学特性,还能提升科研能力和效率,克服科研过程中的挑战。
01
肿瘤微环境中的作用
文章中提到USP2a通过去泛素化作用稳定B7-H4,从而促进肿瘤免疫抑制。利用Tissue Cytometry技术,作者可以定量分析肿瘤组织中B7-H4的表达和分布,深入理解其在肿瘤微环境中的作用;为研究B7-H4与其他免疫细胞(如CD8+ T细胞)的关系,Tissue Cytometry技术在一张病理切片中同时检测多个标记物,提供多参数分析,帮助揭示这些复杂相互作用;研究USP2a的敲除影响了肿瘤细胞与免疫细胞的相互作用时,作者借助Tissue Cytometry技术的空间分析功能,揭示了免疫细胞在肿瘤微环境中的空间分布,这对于理解免疫细胞如何参与肿瘤免疫调节至关重要。
02
高通量自动化的分析
Tissue Cytometry技术拥有国际领先的组织切片原位定量分析思路、算法与验证工作流,参与使用Tissue Cytometry技术的项目,临床医师可以通过实际操作提升其科研技能,特别是关于组织成像和定量分析的技能。使用该技术能够处理来自大量患者的样本,使得研究更具代表性和统计学意义,对于研究如肺腺癌这样具有高度异质性的疾病尤为重要。利用TissueFAXS Cytometry技术的自动化和高通量分析能力,临床医师可以更高效地处理大量样本,从而在繁重的临床工作之余,还能有效进行科研工作。
尽管资金是科研的一大挑战,但以Tissue Cytometry技术作为数据深入分析的基础,提供的高通量和高精度分析可以在有限的预算内产生更多的研究成果,在科研项目中提高资金的使用效率。
03
提升多学科交叉合作,帮助临床拓宽科研领域,打开合作思路
文章中的研究表明,USP2a的作用涉及多个生物学领域,如分子生物学、免疫学和肿瘤学等,这些也同样是Tissue Cytometry技术的应用范畴。利用Tissue Cytometry技术,临床医师可以更容易地与其他领域的专家合作,共同解决复杂的医学问题。相比之下,Tissue Cytometry技术发表文章的影响因子普遍较高,研究结果具有国际影响力,利用该技术,临床医师可以与国际同行分享和讨论研究数据,提升研究的国际认可度。
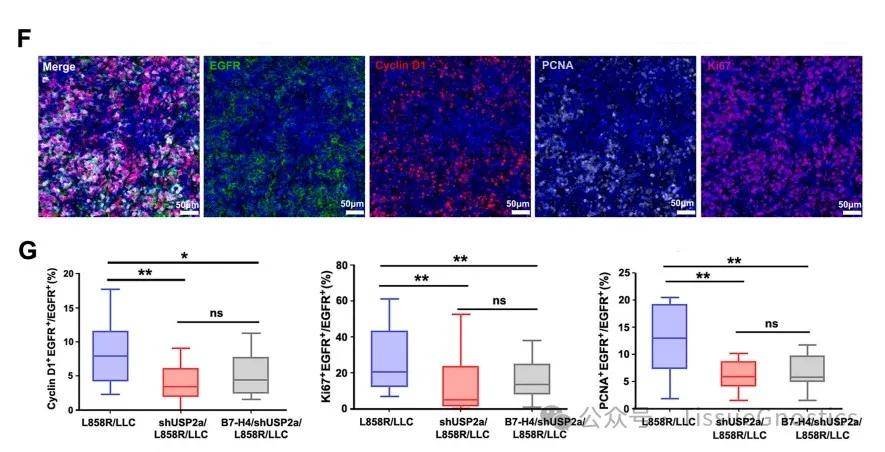
Figrure1. USP2a 可促进免疫缺陷裸鼠的肿瘤增殖
(F) 具有代表性的裸鼠肿瘤多色染色图
在裸鼠体内形成的肿瘤的代表性多色染色:表皮生长因子受体(绿色)、细胞周期蛋白 D1(红色)、PCNA(灰色)、Ki67(紫色)、SN470(蓝色)。
(G) EGFR+ 肿瘤细胞中 Cyclin D1+ EGFR+、Ki67+ EGFR+、PCNA+ EGFR+ 的百分比统计。
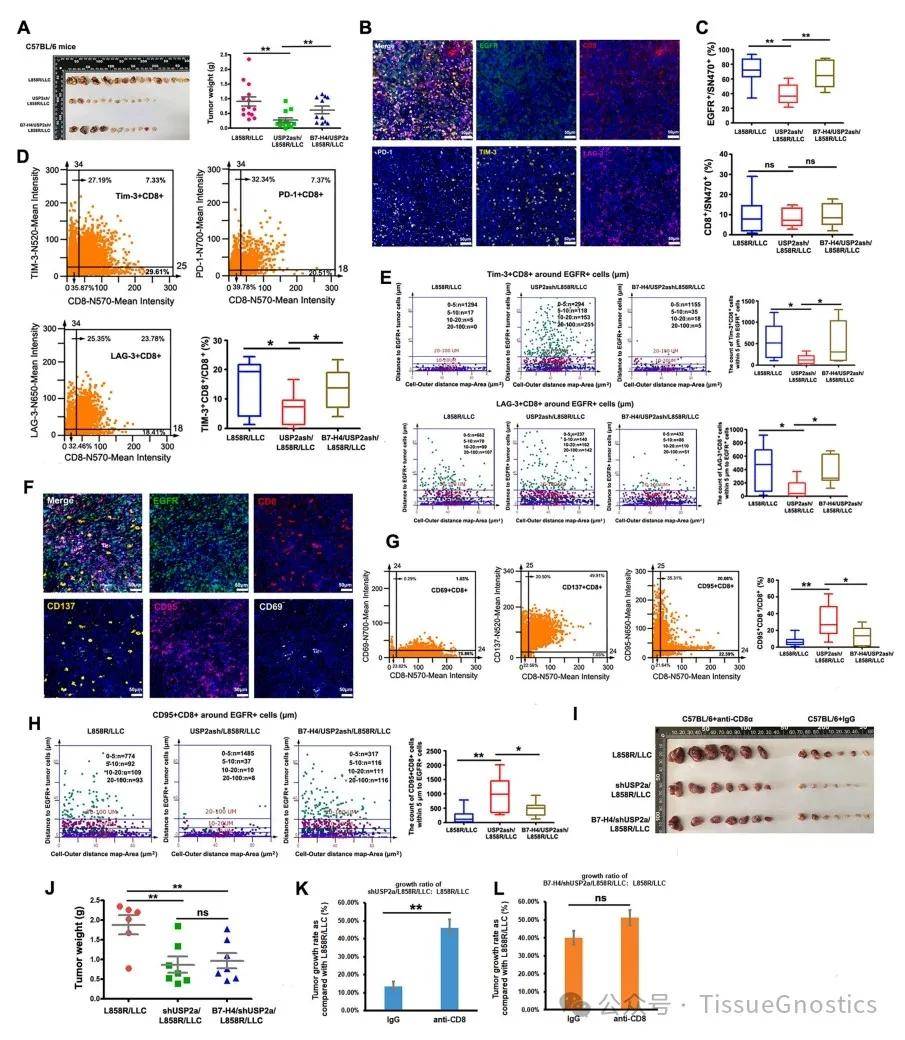
Figure2. USP2a在免疫健全的C57BL/6小鼠中促进肿瘤免疫抑制,B7-H4参与这一过程。
(B) 代表性多色染色显示耗竭的CD8+ T细胞标志物:EGFR(绿色)、CD8(红色)、PD-1(灰色)、Tim-3(黄色)、LAG-3(紫色)、SN470(蓝色)。
(C) 统计了EGFR+肿瘤细胞和CD8+ T细胞在所有细胞中的百分比。
(D) 类流式散点图显示了肿瘤浸润的Tim-3+CD8+、PD-1+CD8+和LAG-3+CD8+ T细胞的百分比。统计分析显示三组之间浸润的Tim-3+CD8+ T细胞百分比存在显著差异。
(E) Tim-3+CD8+和LAG-3+CD8+ T细胞在EGFR+肿瘤细胞距离梯度(0–5 μm、5–10 μm、10–20 μm和20–100 μm)内的空间分布。
(F) 代表性多色染色显示效应CD8+ T细胞标志物:EGFR(绿色)、CD8(红色)、CD69(灰色)、CD137(黄色)、CD95(紫色)、SN470(蓝色)。
(G) 类流式散点图显示了肿瘤浸润的CD69+CD8+、CD137+CD8+和CD95+CD8+ T细胞的百分比。统计分析显示三组之间浸润的CD95+CD8+ T细胞百分比存在显著差异。
(H) CD95+CD8+ T细胞在EGFR+肿瘤细胞距离梯度(0–5 μm、5–10 μm、10–20 μm和20–100 μm)内的空间分布。