激素受体阳性乳腺癌(HR+ BC)被认为对化疗相对不敏感,由于化疗一直是HR+ BC的主要新辅助治疗方法,化疗耐药的未知机制以及化疗如何重塑免疫微环境需要通过高通量技术来探索。

2024年1月,浙江大学医学院附属第二医院倪超教授团队在Cancer Letters 发表文章“Neoadjuvant chemotherapy-induced remodeling of human hormonal receptor-positive breast cancer revealed by single-cell RNA sequencing”。
通过使用单细胞RNA测序和多重免疫荧光染色分析HR+ BC样本(新辅助化疗前后配对),发现先前未被认识的免疫细胞亚群水平增加,包括表达T细胞发育(LMNA)和细胞毒性(FGFBP2)标记的CD8+ T细胞,以及表达增殖标记(ATP1B3)的CD4+ T细胞和表达CD52的巨噬细胞,这些都在新辅助化疗后增加,预示着化疗敏感性,并且它们的抗肿瘤功能也通过体外实验得到了验证。在CD8+ T细胞的免疫检查点表达方面,本文发现它们在新辅助化疗后的变化不一致,LAG3和VSIR减少,而PDCD1、HAVCR2、CTLA4、KLRC1和BTLA增加。
此外,对化疗耐药癌细胞的新型基因组和转录模式的鉴定以及通过TCGA队列验证其预后价值,突显了预测化疗敏感性和克服化疗耐药性的潜在生物标志物。
这类研究至关重要,因为它不仅有助于理解癌症对化疗的复杂动态,还为个体化治疗开辟了新途径,可以根据个体独特的肿瘤特征和免疫反应来制定治疗方案。
实验部分
本文使用TissueGnostics公司TissueFAXS全景多光谱组织扫描定量分析系统对NAC前后样本进行多色荧光图像采集。通过多重免疫荧光技术,结合Tissue Cytometry技术获得了精准的单细胞定量结果以及丰富的组织结构空间定量信息和表达水平。
实验中对特定表型的单细胞进行识别和定量分析,并参考建立了相对于阳性信号对照的空间梯度。在空间表型分析数据的获取策略上,CK+细胞被确定为空间梯度的核心,然后建立5个微环境空间梯度(0-25, 25-50, 50-100, 100-150, 150-200um),并对空间梯度内的多种免疫细胞亚型数量进行统计分析。
另外,实验通过使用多重免疫荧光染色和Tissue Cytometry技术评估了癌细胞和免疫细胞之间的空间相关性。NAC后,我们观察到癌细胞周围0-25um范围内CD4-Tcm-ATP1B3的比例显著减少,这突出了其间接的免疫调节功能,而不是与癌细胞的直接接触。
随着组织原位数据变得越来越重要,空间组学技术能够在单个切片上标记大量的核酸分子和蛋白,并提供这些标记物在组织切片中的精确位置信息。这不仅克服了传统单细胞技术的限制,而且显著增强了所获得的单细胞数据的空间解析度。
Tissue Cytometry技术采用流式散点图,又称组织流式的数据解析策略,通过层层设门圈选+数据实时正反向回溯验证,最终确定筛选阈值和目标亚群的特征一一对应。这种方案具有更强的逻辑性和可操作性,实现了组织/细胞数据、图像以及显微镜下的实时可视化验证。
本文作者联合单细胞测序技术和大量生信分析算法模型,以单细胞分辨率揭示了化疗对肿瘤生态系统的影响,从而揭示了HR + BC中NAC敏感性和耐药性的决定因素;并联合应用了Tissue Cytometry空间多蛋白标记解析技术,不但获得了转录组表达差异的蛋白水平验证结果,更在组织细胞分布的空间关系方面校验了生信聚类分析的预测模型。

Figure 1 化疗后的CD4+阳性细胞。
(E)敏感组HR+BC患者的MIF染色图像
(K)加或不加CD4+T细胞亚群培养4天后B细胞表面CD38的表达比例
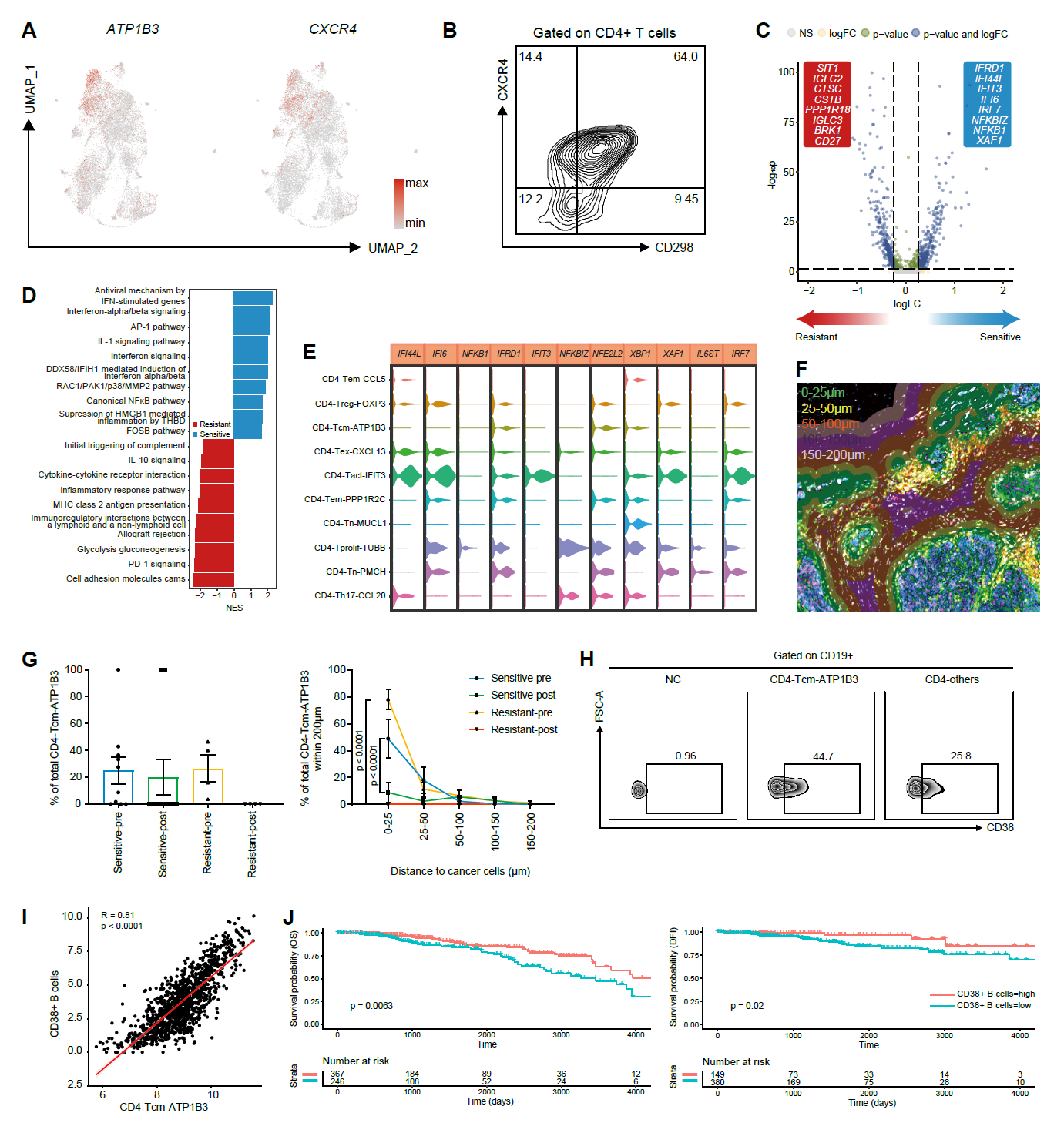
Figure 1 S:(F) 多重免疫荧光(mIF)空间分析的示意图。绿色区域代表距离癌细胞0-25um。所有被绿色区域包围的细胞都是癌细胞。 (G) 每组中距离癌细胞200um内CD4-Tcm-ATP1B3的比例(左图)。距离癌细胞200um内CD4-Tcm-ATP1B3的分布(右图)。
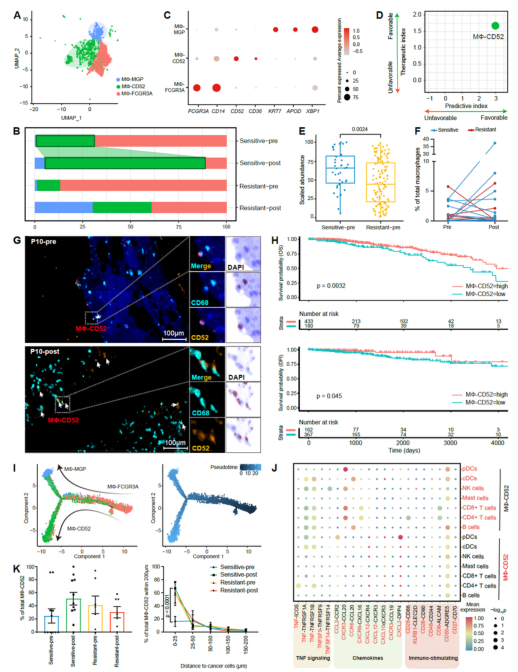
Figure 2 化疗后的巨噬细胞。