免疫疗法为晚期或转移性癌症患者提供替代治疗。尽管免疫疗法延长了总生存期和无进展生存期,但在头颈部鳞状细胞癌(HNSCC)中的反应率仍然较低。浸润到肿瘤区域,包括肿瘤床和肿瘤巢,是与细胞毒性CD8+T细胞功能相关的主要步骤,也是免疫治疗的限制因素之一,特别是对于实体瘤中嵌合抗原受体T细胞免疫疗法(CAR-T)的疗效。然而限制CD8+T细胞浸润的机制知之甚少。

2023年11月,上海市交通大学医学院附属第九人民医院张建军团队在Cancer Research上发表题为“Spatial and single-cell transcriptomics reveal a cancer-associated fibroblast subset in HNSCC that restricts infiltration and anti-tumor activity of CD8+ T cells”的文章。本文研究确定干扰素诱导的MHC-IhiGal-9+CAF形成CD8+T细胞的陷阱,为调节T细胞渗透和功能的肿瘤微环境中的复杂网络提供了洞察力。
文中对具有不同免疫浸润的HNSCC标本进行了空间转录组分析,并对五对肿瘤和邻近组织进行了单细胞RNA测序,揭示了与CD8+T细胞浸润限制和功能障碍相关的特定肿瘤相关成纤维细胞(CAF)亚群。这些CAFs表现出高表达的CXCLs(CXCL9、CXCL10、CXCL12)和主要组织相容性复合物I类(MHC-I)以及半乳凝素-9(Gal-9)的富集。MHC-IhiGal-9+CAFs的比例与CD8+T细胞中TCF1+GZMK+亚群的丰度呈负相关。CAFs上的Gal-9诱导CD8+T细胞功能障碍,并降低了肿瘤浸润TCF1+CD8+T细胞的比例。总之,MHC-IhiGal-9+CAFs的鉴定促进了对CAFs在癌症免疫逃避中的确切作用的理解,并为更有效的HNSCC免疫疗法铺平了道路。
实验部分
为了明确CAFs对头颈部癌的具体影响,文章作者选择采用原位空间转录组技术,对肿瘤微环境及肿瘤内部相关的转录组表达情况进行了分析。这种技术的优势是可以通过空间位置的限定,结合转录测序的方法间接体现大量细胞标志物的表达情况,但同时受限于检测精度和转录组水平的研究,尚无法实现单细胞分辨率下真正蛋白标志物的检测分析。
所以,在空间转录组技术的基础上,研究者需借助组织切片多重免疫荧光技术,通过精准的单细胞识别算法、组织识别算法以及空间分布的关系算法,真正对原位转录组水平的数据进行验证。
作者在应用单细胞分辨率下多重免疫荧光定量分析的技术时,最值得关注亮点,是在最后数据验证的阶段,使用Tissue Cytometry技术,不但实现了肿瘤微环境中Gal-9+ CAFs诱导TCF1+GZMK+CD8+ T细胞功能变化的研究,更开创性的使用了与原位空间转录组分析使用相同的冰冻组织切片,甚至是前后相邻的连续冰冻切片。
相比福尔马林固定-石蜡包埋的组织切片,冰冻切片可以保留更多的组织核酸/蛋白成分,但其组织结构更为脆弱,与载玻片的结合能力较差。所以在传统TSA技术中,每轮染色之间需要微波加热沸腾漂白十几分钟,这样就无法使用冰冻切片作为染色样本。
Tissue Cytometry技术使用TG配套多重免疫荧光染色试剂盒,采取的漂白时间缩短到了十几秒,同时配备有专业的冰冻切片修复-洗脱试剂,洗脱更加温和,这样就解决了冰冻切片上多重免疫荧光的染色问题。
在此基础上,Tissue Cytometry技术拥有的包括单细胞的精准识别与定量,组织结构AI识别,以及通过真实原位像素水平获得的细胞-组织-细胞距离关系(非空间向量坐标)分析能力,都是蛋白水平数据精准定量验证的必要条件。
作为Tissue Cytometry技术的提供方,我们也很高兴可以在作者数据补充阶段,以极其高效的方式完成了相应7色冰冻切片的染色、连续全光谱扫描、光谱拆分及数据分析。

Figure 1 三种免疫型HNSCC细胞空间分布和基因表达谱的异质性
B:排除型免疫表型的PANK(绿色)、CD8α(黄色)、α-SMA(紫色)的多重免疫荧光图像及其区域放大图。
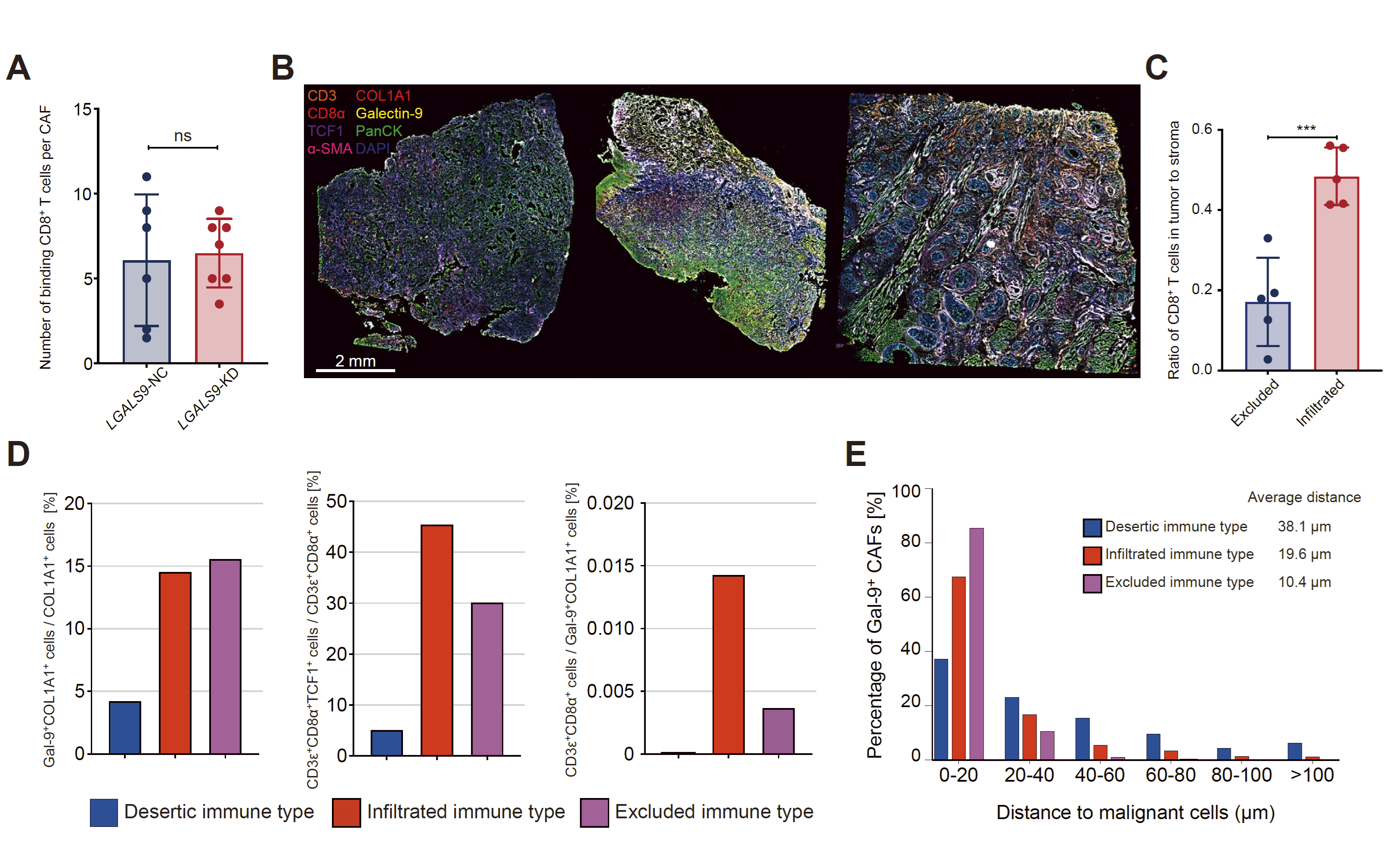
Figure 2 Galectin-9与TCF1+CD8+T细胞分化功能障碍有关。
B、三种免疫表型类型HNSCC的多重免疫荧光染色(CD3、CD8、α、PANCK、COL1A1、GAL-9、α-SMA),相同的标本进行空间转录组测序。
D,三种免疫表型类型HNSCC中Gal-9+成纤维细胞和CD8+T细胞中TCF1+CD8+T细胞的比例,以及CD8+T细胞与Gal-9+成纤维细胞的比例。在这些细胞与恶性细胞(Panck+细胞)之间的不同距离范围内,Gal-9+CAF(Gal9+COL1A1+细胞)的比例。