高致病性呼吸道RNA病毒导致的感染,如流行性感冒与新型冠状肺炎等,其疫情频发且危害严重。I型干扰素(IFNs)是机体抵御病毒入侵的防线,它通过激活固有免疫应答而保护宿主细胞免于病毒感染。
2020年4月7日,复旦大学生物医学研究院/上海市公共卫生临床中心徐建青与张晓燕教授联合执导的研究团队在Science子刊Science Signaling杂志上发表题为“IFN-κ suppresses the replication of influenza A viruses through the IFNAR-MAPK-Fos-CHD6 axis”的研究文章,并获得当期特色文章的封面推介。
该研究通过不同致病性Influenza A virus (甲型流感病毒,IAV)感染的小鼠模型,发现流感病毒H9N2轻症较H7N9重症感染能更早地诱导I类IFN成员IFN-κ。与IFN-a和b通过STAT1抑制流感不同,IFN-κ通过IFN受体亚基IFNAR1和IFNAR2,激活MAPK通路进而上调cFos-CHD6通路而抑制流感病毒复制。该研究还发现IFN-κ预处理可保护小鼠预防流感病毒感染。上述研究结果提示,在疫情暴发时IFN-κ的免疫干预有望降低易感人群的罹患率,而且在病毒感染早期的干预可改善患者的临床转归。
该团队前期研究中发现,在人神经胶质瘤细胞中IFN-k可抑制寨卡病毒(ZIKV)复制,而ZIKV可通过AXL介导的STAT1/STAT2通路调节SOCS1表达进而下调I型 IFN信号转导基因的激活和ISGs表达促进自身感染。但是单一基因突变的IFN-κ依然显示抑制ZIKV复制效果,而突变型IFN-κ则显著降低了抑制流感病毒的作用。提示IFN-κ抗ZIKV存在不同的作用机制,也许意味着对于不同的RNA病毒IFN-κ可能利用了不同的效应机制。未来的研究如能进一步解析IFN-κ抑制RNA病毒共性机制,必将为开发广谱抗呼吸道RNA病毒药物提供有力的科技支撑。
针对高致病性呼吸道疾病如流感,新冠肺炎等,TissueFAXS Cytometry技术具有非常大的应用意义:
1 HE/IHC样本组织:自动对简单HE染色下肺组织中所有细胞轮廓进行识别,结合自动肺泡/支气管的组织识别功能,迅速判断炎性细胞数量、浸润程度、上皮脱落面积、纤维化程度等指标。
2 IF样本组织:结合标记特异性蛋白marker免疫组化或免疫荧光技术,可以进一步研究肺组织微环境中浸润的免疫细胞表型、上皮细胞化生程度等实验室准确定量指标。
3病毒原位研究:利用特异性核酸荧光探针以及免疫荧光技术,共同标记病毒相关蛋白的表面抗原及核酸核心,不但可以从图像中准确定量病毒在细胞内外的数量及位置 — 建立通过肉眼可以判断的病毒载量定量标准,同时分析病毒的增殖侵袭过程和组织的相互空间关系!
实验方法
组织病理学和RNA原位杂交实验利用TissueFAXS Confocal Plus 200系统,扫描5um厚的小鼠肺组织HE样本和CHD6原位杂交样本。 并通过StrataQuest软件对获取的图像进行分析,可以在HE染色下通过形态学识别单个支气管/肺泡腔体,准确定量支气管数量、炎性细胞数量和炎性浸润区域面积,然后对组织病理学进行评分。
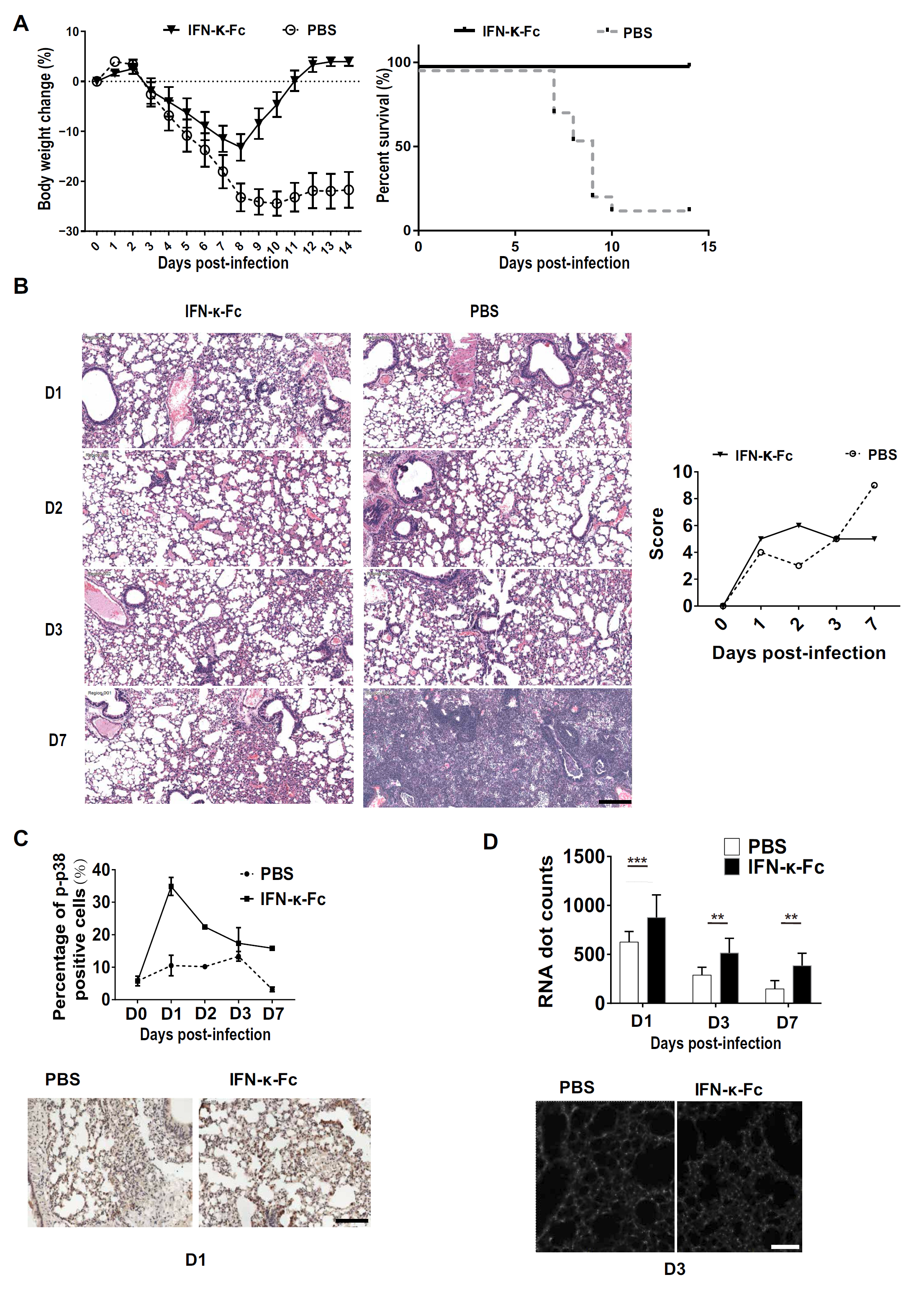
IFN-κ预防小鼠甲型流感感染的组织学证据
(B)在感染后第1、2、3和7天(D1,D2,D3和D7)IFN-γ-Fc治疗组和PBS治疗组的HE染色肺组织图像。
(C)IFN-κ-Fc和PBS治疗组中肺组织中p-p38的IHC图像及定量分析结果,可见在D1中,IFN-κ-Fc达到最高值,以及在D0-D7中显著高于PBS治疗组。
(D)肺组织中CHD6 mRNA的原位杂交图像及定量分析结果,可见在D1中RNA表达量达到最高值,以及在D1-D7中显著高于PBS治疗组,与IHC在蛋白水平定量分析结果一致。