癌症射频消融术(Radiofrequency Ablation, RFA)是近年迅速发展的一门微创手术,通过插入肿瘤组织中的电极尖端射入高频交流电,使电极周围的肿瘤内细胞死亡,肿瘤组织发生凝固坏死同时使肿瘤周围的血管组织凝固形成一个反应带,使其不能向肿瘤继续供血,实现防止肿瘤转移的作用。消融后的肿瘤组织依然存在于体内,可刺激机体免疫力并产生抗肿瘤性细胞毒性抗体,诱导细胞毒性T细胞免疫。
RFA被认为早期肝细胞癌(HCC)的重要治疗手段。肝癌患者受益于射频消融治疗的安全性、微创性和有效性。然而,与手术切除相似,RFA治疗的5年复发率可能高达70%,其复发由多种机制共同参与,包括肿瘤边缘不清晰,微转移灶未被发现,射频消融不足(iRAF)等。尤其是iRAF还可促进肝癌细胞恶行转化、肿瘤干性增加、肿瘤细胞增值以及内皮通透性增加,极大提升了HCC后期复发的风险。
是否存在一种技术,可以针对肿瘤组织原位微环境进行精准的
单细胞定量,解析其信号作用通路与空间分布的真实关系?该技术工具的
精准可靠程度,将直接影响到诸如RFA临床研究
等极其依赖组织切片样本的研究领域。在本文中,
TissueFAXS Cytometry技术给出了一份不错的答案。

近日,中山大学附属第一医院匡铭教授团队在肝细胞癌射频消融治疗后复发的机制研究上取得重要进展。该研究成果在国际著名学术期刊Hepatology (IF=17)上发表。
甲基转移酶1 (METTL1)是一种tRNA的m7G修饰酶,通过影响基因的翻译,调控肿瘤的发生发展过程,据报道METTL1可以促进HCC的发展。
然而,表观遗传调控是否以及如何参与肝细胞癌射频消融治疗后的免疫抑制微环境尚未报道。
该文章揭示了METTL1在调节免疫抑制微环境中的作用,并表明对于恢复抗肿瘤免疫力和预防肝细胞癌RFA治疗后复发;
阻断METTL1-TGF-β2-PMN-MDSC轴可能是一个新的治疗策略,值得进一步临床研究,为研发预防和治疗肝癌消融治疗后复发的药物提供了新的思路。
RFA可通过诱导细胞大量死亡,从而增强肿瘤抗原的释放,为诱导抗肿瘤免疫,消除残留肿瘤细胞创造有利条件。
然而,这种优势被RFA后的免疫抑制微环境所削弱,这主要归因于具有免疫抑制倾向的髓系细胞的积累,如肿瘤相关巨噬细胞(TAM)和髓系来源的抑制细胞(MDSCs)。
在机制上,热介导的METTL1上调诱导MDSC促进TGF-β2翻译形成免疫抑制环境。肝脏特异性过表达或敲除METTL1可显著影响PMN-MDSCs的积累,进而影响CD8+ T细胞的浸润。
相比而言,完全RFA (cRFA)成功消除了肿瘤,RFA不足(iRFA)处理的小鼠表现出增强的肿瘤生长和转移,PMN-MDSC积累增加和CD8+ T细胞减少。
通过抗ly6G抗体阻断METTL1-TGF-β2-PMN-MDSC轴,或敲除肝癌内生性METTL1或Tgfb2,或阻断TGF-β信号通路,可显著缓解iRFA诱导的肿瘤进展,恢复CD8+ T细胞群。

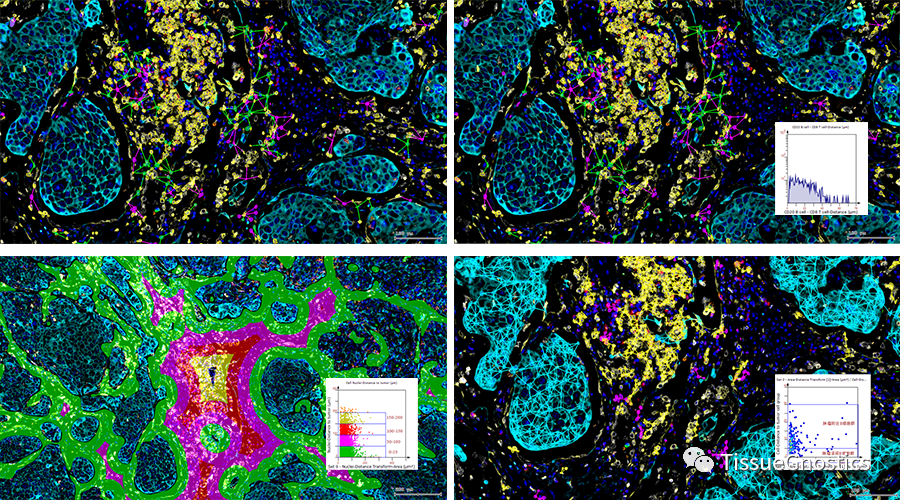
对于多重免疫荧光染色的样本,文中均使用TissueFAXS多光谱成像系统(TissueGnostics, Austria)进行扫描。对成像结果使用了StrataQuest分析软件在单细胞水平上进行分析。在分析方法上,通过StrataQuest分析软件可以得到不同颜色通道的灰度图,在DAPI通道图像上应用核识别算法对单个细胞进行识别和圈定。然后,通过平均灰度值计算每个细胞每种不同Marker的表达量。绘制强度直方图和散点图,通过手动设置cut-off以及图像回溯功能得到每个Marker的阳性细胞数和阴性细胞数。
传统通过软件算法进行单细胞分析,只能进行原始的细胞核简单识别,细胞质、细胞膜等结构依赖于通过算法扩大细胞核轮廓,无法完成真实的细胞质形态学识别。TissueFAXS Cytometry技术不但可以针对每个荧光通道的细胞质形态进行圈选,还可以结合细胞核轮廓,实现单细胞的核/质/膜等亚细胞结构真实染色强度和形态的分析。
通过免疫组化和多重免疫荧光(mIF)染色,发现在RFA后复发的HCC中,METTL1表达增强,伴有CD11b+CD15+ PMN-MDSCs的增加和CD8+ T细胞的减少。
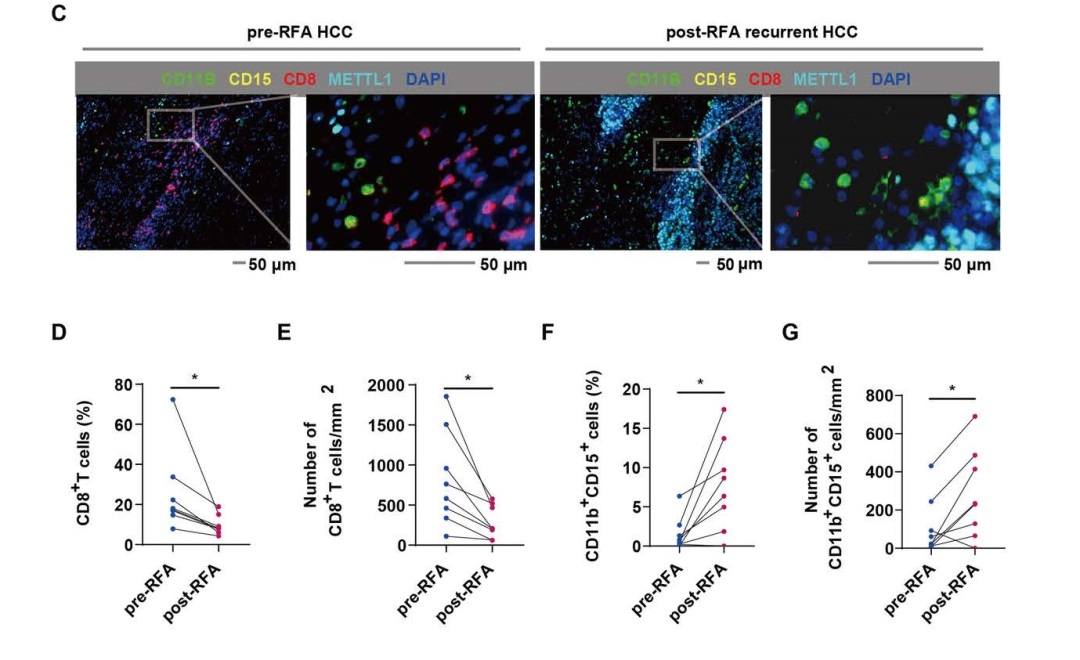
Figure1. 多重免疫荧光染色检测8对匹配的RFA前后HCC多种免疫细胞比例和数量
为了阐明RFA治疗对HCC免疫微环境的影响,文中对8对匹配的RFA前后HCC样本进行多重免疫荧光染色,检测多种免疫细胞。发现与RFA前相比,RFA后HCC中CD11b+CD15+ PMN-MDSCs的比例和数量增加,CD8+ T细胞减少。这表明METTL1与免疫抑制肿瘤微环境相关。
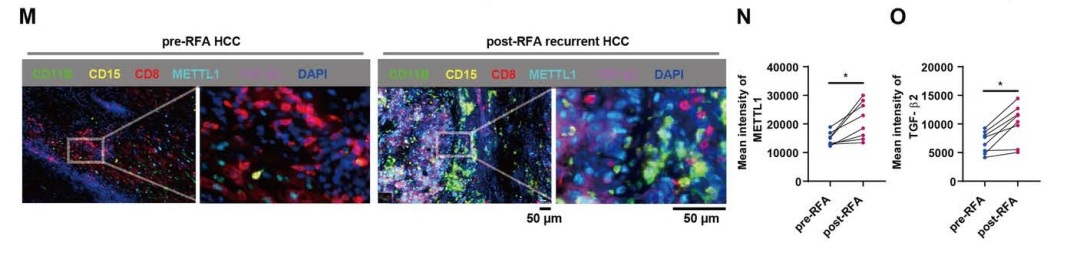
Figure 2. 多重免疫荧光染色检测RFA前后HCC多种免疫细胞比例和数量
为了进一步验证热诱导的METTL1是否能够在原发性人HCC中上调TGF-β2,对匹配的RFA前和后HCC样本进行了多重免疫荧光染色,检测CD11b、CD15、CD8、METTL1、TGF-β2和DAPI。在RFA后复发的HCC中,METTL1和TGF-β2一致高表达,CD11b+CD15+ PMN-MDSCs数量增加,CD8+ T细胞数量减少。这一数据证实了METTL1-TGF-β2-MDSC轴在RFA后复发的HCC中存在。
文中研究揭示了iRFA诱导的METTL1上调协同PMN-MDSC介导的免疫抑制促进残余HCC发展。METTL1具有多种肿瘤内、外功能,是治疗癌症的新靶点。靶向METTL1-TGF-β2-MDSC轴将为提高RFA治疗后的免疫监测和预防HCC复发开辟新的途径。