肝细胞癌(HCC)是世界上发病率和死亡率最高的肿瘤之一,其发病率和死亡率分别位列第六位和第四位。转化生长因子-β(TGF-β)作为肿瘤免疫微环境中重要的免疫信号分子,可以和细胞表面的TGF-β受体相结合,激活信号通路,影响肿瘤微环境中肿瘤细胞和免疫细胞功能,在肿瘤的发生发展过程中扮演着重要的角色。在HCC的发生发展过程中,肿瘤微环境中肿瘤细胞与免疫细胞的互作影响肝癌免疫应答的分子机制仍不清楚。果糖-1,6-二磷酸醛缩酶B(ALDOB)作为糖酵解过程中的重要代谢酶,其表达随着肝癌的发生发展而逐渐降低,ALDOB表达下调可能引起肿瘤细胞代谢重构并促进肝癌。同时也有研究发现,GLUTI/ALDOB/G6PD轴也影响胰腺癌的化疗效果,然而,肝癌肿瘤细胞ALDOB的表达如何影响肿瘤免疫微环境及具体机制仍需进一步研究。

中国科学院上海营养与健康研究所尹慧勇教授研究组在国际学术期刊Hepatology在线发表了题为“ALDOB/KAT2A Interactions Epigenetically Modulate TGF-β Expression And T Cell Functions in Hepatocellular Carcinogenesis”的合作研究成果,揭示了肝癌组织中肿瘤细胞果糖-1,6-二磷酸醛缩酶B(ALDOB)的缺失通过表观遗传调控促进TGF-β的转录表达,进而引起肝癌微环境中效应T细胞的耗竭,促进肝细胞癌的新机制。
本研究从临床样本出发,对肝癌病人的肿瘤组织进行流式细胞分析和Western Blot检测,发现ALDOB的表达和CD8+ T细胞的浸润呈显著负相关,即肿瘤组织ALDOB的下调表达反而增加CD8+ T 细胞浸润;进一步对肝癌组织内CD8+ T细胞中的PD1、CTLA-4免疫抑制分子进行流式检测,发现这些CD8+ T细胞处于免疫耗竭的状态,提示肿瘤细胞ALDOB的表达影响肝癌免疫微环境。通过研究发现肝癌细胞内ALDOB可以入核与KAT2A相互结合,抑制TGFB1启动子区域H3K9的乙酰化,降低TGFB1转录表达,从而降低肿瘤组织内Treg细胞的数量和维持肝癌的免疫微环境中CD8+ T细胞的功能;相反,肿瘤细胞ALDOB的丢失不仅可以通过代谢重构上调糖酵解、PPP以及TCA,生成大量的乙酰辅酶A,促进肿瘤细胞糖脂代谢,还可以解除对KAT2A活性的抑制,增加H3K9的乙酰化并上调TGF- 表达,影响CD8+ T细胞和Treg细胞的数量和功能,促进肝癌。本研究发现了糖酵解内的重要代谢酶ALDOB通过进入细胞核表观调控TGFB1基因的表达,从而影响肝癌免疫微环境免疫应答的全新分子机制,为肝癌的免疫治疗提供潜在新策略。
实验部分
本文使用TissueGnostics公司TissueFAXS Plus全景组织扫描定量分析系统获取图像。
Panel 1 : ALDOB,FOXP3,DAPI
Panel 2 : CD3,CD4,DAPI
本文大量使用了流式细胞技术对细胞表型及细胞表达水平进行了量化分析,但是在关键数据上,可以进一步使用Tissue Cytometry技术作为原位校验方法的验证标准。相比传统的研究思路,这样获得的数据不但更加全面,并且从单细胞蛋白表达层面对空间分布关系进行研究,是最能反映生物体真实情况的研究水平。
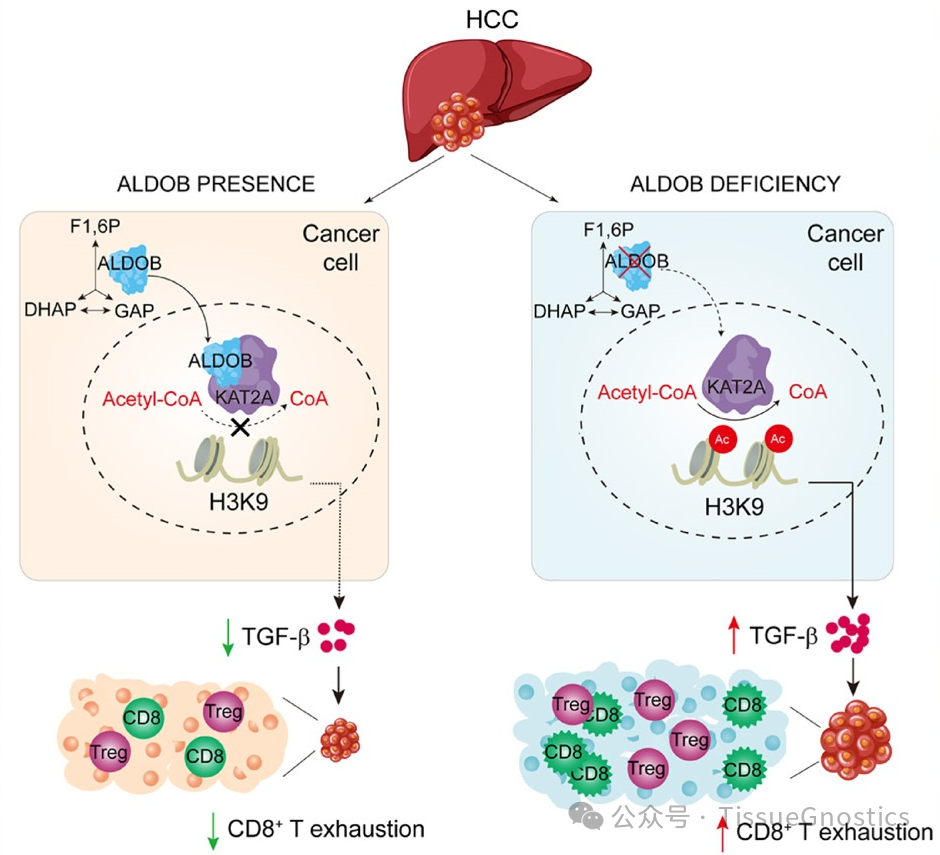
ALDOB通过KAT2A调控TGF-β转录表达进而影响HCC免疫微环境的机制图
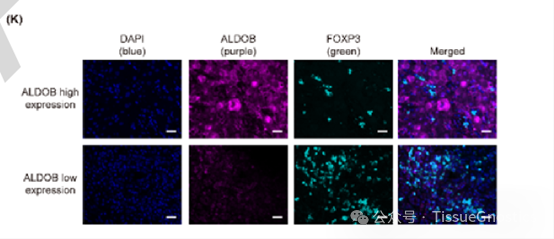
TissueFAXS Plus全景组织扫描定量分析系统获取图像
部分内容转载自:营养与健康所尹慧勇研究组合作发现肝癌肿瘤细胞代谢影响肿瘤免疫新机制----中国科学院上海营养与健康研究所 (sinh.ac.cn)